题目内容
7.NH3及其盐都是重要的化工原料.(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为ACG.

(2)按图装置进行NH3性质实验.

①先打开旋塞1,B瓶中的现象是出现白烟,原因是A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟,稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红.
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究温度对溶液中NH4Cl水解程度的影响.
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
| 物理量 实验序号 | V(溶液)/ml | … | |||
| 1 | 100 | … | |||
| 2 | 100 | … |
分析 (1)实验室用加热固体氯化铵和熟石灰制取氨气(2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,根据氨气为易溶于水密度比空气小的气体性质选择收集装置,氨气极易溶于水,尾气处理需考虑倒吸,据此分析解答;
(2)①根据A、B容器压强以及A、B混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,氯化铵为强酸弱碱盐,溶液呈酸性,据此分析;
(3)①根据影响NH4Cl水解的因素以及题干提供的限选试剂与仪器分析;
②氯化铵为强酸弱碱盐,水解溶液呈酸性,所配制溶液的体积,根据温度不同,盐类水解后PH不同,进行设计表格数据;
③读取的待测物理量的数值为Y,Y为PH值,PH=-lgc(H+)可求算出氢离子浓度,根据NH4++H2O?NH3•H2O+H+,求解NH4Cl水解反应的平衡转化率.
解答 解:(1)实验室用加热固体氯化铵和熟石灰制取氨气(2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,因防止药品中的湿存水以及反应产生的水使反应试管受热不均匀,所以选择试管口向下的A装置制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向下排空气法收集,所以选择C装置,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗空间大,水柱不易极速上升,能防止倒吸,故选G装置,
故答案为:ACG;
(2)①A容器压强为150KPa,B容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,
故答案为:出现白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O?NH3•H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,
故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红;
(3)①盐类水解,水解离子浓度越大,水解程度越小,盐类水解为吸热反应,温度越高,水解程度越大,根据题干提供的限选试剂与仪器中的温度计、恒温水浴槽(可调控温度),可选择温度不同对盐类水解的影响,
故答案为:温度;
②根据①可知,该实验为探究温度对氯化铵水解的影响,氯化铵为强酸弱碱盐,水解溶液呈酸性,所以可根据不同温度下,水解的溶液的pH进行判断,所配制溶液的体积都为100mL,m(NH4Cl)相同都为m g,温度不同,分别为T1℃、T2℃,分别测水解后pH,
故答案为:
| 物理量 实验序号 | V(溶液)/mL | NH4Cl质量(g) | 温度(℃) | pH |
| 1 | 100 | m | T1 | Y |
| 2 | 100 | m | T2 | Z |
故答案为:$\frac{1{0}^{-Y}×0.1×53.5}{m}×100%$.
点评 本题主要考查了氨的制备以及铵盐的性质,掌握实验室制取氨气的原理以及铵盐的水解规律是解答的关键,题目难度中等.

 应用题作业本系列答案
应用题作业本系列答案| A. | 该溶液c(H+)≥0.1 mol/L | |
| B. | 把该溶液稀释成1 L后,pH≥2 | |
| C. | 把该溶液稀释成1 L后,pH≤2 | |
| D. | 中和此溶液需0.1mol/L的NaOH体积≥100mL |
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
 C、N、O、Al、Si、Cu是常见的六种元素.
C、N、O、Al、Si、Cu是常见的六种元素.(1)Si位于元素周期表第三周期第IVA族;
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子;
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动.t1时,原电池中电子流动方向发生改变,其原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al的进一步反应.
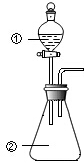 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
