题目内容
12.下列解释实验事实的方程式不正确的是( )| A. | Mg(OH)2悬浊液中滴加浓的NH4Cl溶液,沉淀溶解:Mg(OH)2+2H+═2H2O+Mg2+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅2NO2 (红棕色,g)?N2O4(无色,g)△H<0 | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 将饱和FeCl3溶液滴入沸水并煮沸至红褐色:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ |
分析 A.漏掉铵根离子与氢氧根离子的反应;
B.2NO2(g)?N2O4(g)△H<0,降低温度,平衡正向移动;
C.硝酸过量反应生成三价铁离子;
D.氯化铁水解生成氢氧化铁胶体和氯化氢.
解答 解:A.Mg(OH)2悬浊液中滴加氯化铵浓溶液,氢氧化镁与铵根离子反应生成一水合氨和镁离子,反应的离子方程式为:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+,故A错误;
B.2NO2(g)?N2O4(g)△H<0,降低温度,平衡正向移动,NO2浓度降低,颜色变浅,故B正确;
C.稀硝酸具有强氧化性,可以把单质铁氧化成铁离子,正确的离子方程式为3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O,故C错误;
D.将饱和FeCl3溶液滴入沸水并煮沸至红褐色,离子方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故D正确;
故选:AC.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应必须遵循客观事实,遵循原子个数守恒规律,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.2009年12月16日,国家标准化管理委员会在其官方网站发出《关于电动摩托车相关标准实施事项的通知》.通知要求,《电动摩托车和电动轻便摩托车通用技术条件》等4项国家标准中,涉及电动轻便摩托车内容暂缓实施.这似乎给电动车行业一线生机,电动车电源最常用的是由法国的普朗泰于1860年发明的铅蓄电池,其工作原理为PbO2+2H2SO4+Pb$?_{充电}^{放电}$2PbSO4+2H2O.下列关于铅蓄电池的说法不 正确的是( )
| A. | 在放电时,该电池的负极材料是铅板 | |
| B. | 在充电时,铅蓄电池的负极与充电器电源的负极相连 | |
| C. | 在放电时,外电路中电流流向为:正极→外电路→负极 | |
| D. | 在充电时,阳极发生的反应为:PbSO4+2e-═Pb+SO${\;}_{4}^{2-}$ |
7.下列反应的离子方程式错误的是( )
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ | |
| C. | 氢氧化铝与足量盐酸反应Al(OH)3+3H+═Al3++3H2O | |
| D. | 少量CO2通入氢氧化钠溶液中CO2+2OH-═CO32-+H2O |
 某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:
某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下: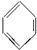 $→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$
$→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$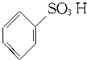
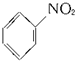 $\stackrel{Fe,HCl,H_{2}O}{→}$
$\stackrel{Fe,HCl,H_{2}O}{→}$
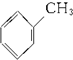 $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$

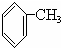 C
C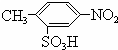 D
D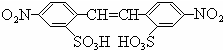 .
.