题目内容
【题目】I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为_________。
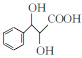
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含元素的第一电离能由大到小的顺序为___________,碳原子的轨道杂化类型为_______。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sr3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为___________。
Ⅱ.ZnCl2浓溶液常用于除去金属表面的氧化物,如与FeO反应可得 Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有________(填选项字母)。
A 离子键 B 共价键 C 金属键 D 配位键 E 范德华力 F 氢键
Ⅲ.某微粒的球棍模型如下图所示。
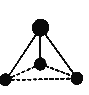
(5)已知含有1个碳原子和3个氢原子,请写出该微粒的化学式:_____。
Ⅳ.铜与氧元素形成的晶胞如下图所示:
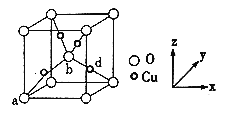
(6)晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为___________,已知该晶体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为___________cm(列出计算式即可)。
【答案】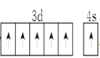 N>O>H>C sp3和sp2 没有未成对电子(d轨道上电子为全空或全充满) AC CH3— (
N>O>H>C sp3和sp2 没有未成对电子(d轨道上电子为全空或全充满) AC CH3— (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)Cr元素位于周期表第四周期ⅥB族,原子核外电子数为24,核外电子排布式为1s22s22p63s23p63d54s1,价电子轨道表达式为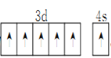 ,故答案为:
,故答案为: ;
;
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含的元素有H、C、N和O,同周期元素从左到右,元素第一电离能逐渐增大,但N原子的2p能级含有3个电子,为半满稳定状态,第一电离能较相邻元素高,则第一电离能的大小顺序为N>O>H>C;NH2CH2COOH分子中含有饱和碳原子和羧基不饱和碳原子,饱和碳原子为sp3杂化,羧基不饱和碳原子为sp2杂化,故答案为:N>O>H>C;sp3和sp2;
(3)Sc3+的电子排布式为1s22s22p63s23p63d,Cr3+的电子排布式为1s22s22p63s23p63d5,Fe2+的电子排布式为1s22s22p63s23p63d6,Zn2+的电子排布式为1s22s22p63s23p63d10,由电子排布式可知水合离子的颜色与d轨道未成对电子有关,没有未成对电子,即d轨道上电子为全空或全充满的Sc3+、Zn2+的水合离子为无色,故答案为:没有未成对电子(d轨道上电子为全空或全充满);
(4) Fe[Zn(OH)Cl2]2的水溶液中存在的微粒有Fe2+、[Zn(OH)Cl2]—和H2O,[Zn(OH)Cl2]—离子中存在配位键和氢氧共价键,H2O分子中存在氢氧共价键,H2O分子间存在范德华力和氢键,不存在离子键和金属键,故答案为:AC;
(5)由球棍模型可知,该微粒为三角锥形,说明C原子的价层电子对数为4,孤对电子数为3,则化学式为CH3—,故答案为:CH3—;
(6)由晶胞示意图可知,位于顶点的a和体心的b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),d位于体对角线的![]() 处,则d的坐标参数为(
处,则d的坐标参数为(![]() ,
,![]() ,
,![]() );晶胞中Cu原子的个数为4,O原子的个数为8×
);晶胞中Cu原子的个数为4,O原子的个数为8×![]() +1=2,则化学式为Cu2O,Cu2O的摩尔质量为144g/mol,设晶胞的参数为a,晶胞的质量为a3ρ=
+1=2,则化学式为Cu2O,Cu2O的摩尔质量为144g/mol,设晶胞的参数为a,晶胞的质量为a3ρ=![]() ,则a=
,则a=![]() cm,故答案为:(
cm,故答案为:(![]() ,
,![]() ,
,![]() );
);![]() 。
。