��Ŀ����
����Ŀ���о���ѧϰС�����������й�װ�ý���̽��ʵ�飬�ش�������⡣
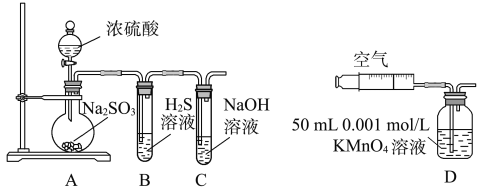
(1)д��A�з�Ӧ�Ļ�ѧ����ʽ��____________________��
(2)ʵ��ʱ������װ��A�з�Һ©��������������Һ����������������ֹͣ������ܵ�ԭ����__________________________��
(3)װ��B�е���Һ���ֻ��ǣ���ʵ��֤��SO2����______�ԡ�
(4)ʵ��ⶨװ��C����Һ�ʼ��ԡ���ҺΪʲô�ʼ����أ�����в�ͬ������������ɵ�Na2SO3ˮ�⣻������������ʣ�ࡣ�����ʵ�鷽��֤���������������ѡ�������Լ�����ʵ�飺Na2SO3��Һ����̪��Һ����ˮ��BaCl2��Һ��ϡ���ᡣ
ʵ�鲽�� | ʵ����� | Ԥ����������� |
(5)��һС������װ��D����ʵ�飺��ע������װ��D��ע��V mLʵ�����Ʊ�SO2��Ŀ���������Һ�պ���ɫ��ֹͣʵ�顣��С���ʵ��Ŀ����_________________________��
���𰸡�(1)Na2SO3(��)��H2SO4(Ũ)===Na2SO4 ��SO2����H2O
(2)û�д�Һ©�����Ͽڻ���(���Һ©���Ͽڻ����ϵİ���û�����Һ©���ϵ�С����ͨ)������������������ͨ
(3)����
(4)
ʵ�鲽�� | ʵ����� | Ԥ����������� |
�� | ȡ������Һ���Թܣ����뼸�η�̪��Ȼ�����������BaCl2��Һ | ��Һ�ȱ�죬Ȼ������������������ɫ��ȥ����˵������ȷ������ɫ������ȥ����˵������ȷ |
(5)�ⶨʵ���ҿ�����SO2�ĺ���
��������(1)A���Ʊ�SO2���壬������Ӧ�Ļ�ѧ����ʽ��Na2SO3(��)��H2SO4(Ũ)===Na2SO4 ��SO2����H2O��(2)��Һ©����Һʱ��ĥ�����ϵİ�����©���ھ��ϵ�С��Ҫ������ʱ©������Ŀ�����ͨ��ѹǿ��ȣ����Һ©�����Ͽڻ�����©�����Һ�����˳������������Һ����������������ֹͣ��(3)װ��B�з�ӦΪSO2��2H2S===3S����2H2O���÷�Ӧ����SO2�������ԡ�(4)��������ʵ��̽����֤���ʼ���ԭ��ͨ��ָʾ��(��̪)���Ȼ�����Һ����֤��



