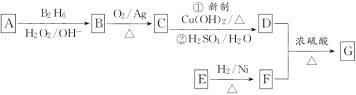
题目内容
【题目】把a L含(NH4)2SO4和NH4NO3的混合液分成两等份。一份用b mol烧碱刚好把NH3全部赶出;
另一份与BaCl2溶液恰好完全反应,消耗c mol BaCl2,则原溶液中c(NO![]() )为( )
)为( )
A.![]() mol/L B.
mol/L B.![]() mol/L
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
【答案】B
【解析】
试题分析:设每份中NH4+的物质的量为x,SO42-的物质的量为y,据反应NH4++OH-═NH3+H2O可知x=b,则每份中NH4+的物质的量为bmol,同理据反应Ba2++SO42-═BaSO4↓可知y=c,则每份中SO42-的物质的量为cmol,由aL含硫酸铵和硝酸铵的混合液分成两等份,则原溶液中NH4+的物质的量浓度为2b/amol/L,原溶液中SO42-的物质的量浓度为2c/amol/L,设原溶液中N03-的物质的量浓度为z,由溶液不显电性,根据电荷守恒可知,2b/amol/L×1= 2c/amol/L×2+z×1,解得z=![]() mol/L,答案选B。
mol/L,答案选B。

练习册系列答案
相关题目