题目内容
Ⅰ在催化剂作用下,CO2和H2可以制取甲醇。用工业废气中的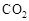 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
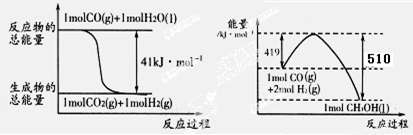
写出由二氧化碳和氢气制备甲醇的热化学方程式: 。
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂。最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
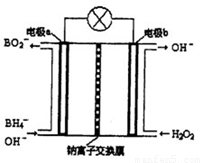
(1)电极b为 (填“正极”或“负极”),电极a上发生反应的电极反应式为 。
(2)电池工作时,Na+向 极(填“a”或“b”)移动,当左槽产生0.0125molBO2—离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为_________
ⅠCO2(g)+3H2(g)=CH3OH(l)+H20(l) △H=-50kJ/mol
Ⅱ.(1)正 BH4-+8OH- -8e- =BO2- +6H2O (2)b 13 (3)0.4NA
【解析】
试题分析:Ⅰ如图所示可以得出两个热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;2H2(g)+CO(g)=CH3OH(l) △H=-510kJ/mol;根据盖期定律,用后面的方程式减去前者方程式可得:CO2(g)+3H2(g)=CH3OH(l)+H20(l) △H=-50kJ/mol。(1)正极电极反应式为H2O2+2e-=2OH-,故电极b为正极,负极发生氧化反应生成BO2-,电极a反应式为BH4-+8OH--8e-=BO2-+6H2O。(2)原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区。当左槽产生0.0125molBO2—离子时,根据电子守恒,右槽生成氢氧根离子0.1mol,右槽溶液pH=13。(3)根据电子守恒原理,用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。电解方程式为:2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 ,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,说明有0.1mol硫酸生成,则电解过程中转移电子数目为0.2mol。
考点:本题考查原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意化合价的变化。




 则反应①、②、③的反应类型分别为
则反应①、②、③的反应类型分别为

 +Br2
+Br2 +HBr
+HBr
 ↓+3HBr
↓+3HBr