题目内容
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
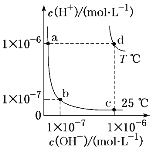
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
D. 温度为T ℃时,0.05 mol·L-1Ba(OH)2溶液的pH=11
【答案】C
【解析】
A、d点所在温度下,水的离子积为10-12,而食盐水溶液显中性,则d点对应的食盐水pH=6,A正确;
B、向a点对应的醋酸溶液中滴加氢氧化钠溶液至b点,溶液显中性,即c(H+)=c(OH-),根据电荷守恒可知c(H+)+c(Na+)=c(OH-)+c(CH3COO-),故c(Na+)=c(CH3COO-),B正确;
C、酸对水的电离有抑制作用,盐的水解对水的电离有促进作用,故a点对应的稀硫酸溶液中水的电离程度小于c点对应的CH3COONa溶液中水的电离程度,C错误;
D、T℃时,水的离子积为10-12,0.05mol/L氢氧化钡溶液中氢氧根离子的浓度是0.1mol/L,则溶液中氢离子浓度是10-11mol/L,因此溶液的pH=11,D正确;
答案选C。

【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
D. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
【题目】下表为元素周期表的一部分,根据表中序号对应元素回答有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,原子半径最大的是___;(填写元素符号);
(2)表中能形成两性氢氧化物的元素是___(填元素符号),分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式分别是___、___。
(3)元素①组成的单质的电子式为___;用电子式表示⑥的氢化物的形成过程___。
(4)②和③的单质加热时反应生成物质X,其化学式为___,该物质中含有的化学键的类型为___。