题目内容
【题目】我国著名化学家申泮文教授对硼烷化学的研究开启了无机化学的新篇章;硼族元素及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为________,B原子核外电子有_____个不同的能级。
(2)硼、铝同主族,晶体硼的熔点为2300℃,金属铝的熔点为660.3℃,试从晶体结构解释其原因:_________________________________________________。
(3)实验测得AlCl3的蒸气是缔合的双分子(Al2Cl6),它的结构和球棍模型如图:
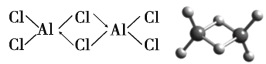
已知在Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于______分子(填“极性”或“非极性”),其中Al原子的轨道杂化类型是_________。
(4)氨硼烷(NH3BH3)是一种高性能新型储氢材料,分子中存在配位键,提供孤电子对的成键原子是________(填元素符号),写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(5)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图1所示。试解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因_________________________________________。
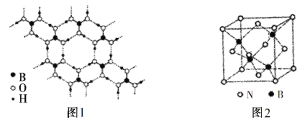
(6)氮化硼(BN)晶体是一种特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图2所示。
①氮化硼晶体中与氮原子直接连接的硼原子构成的几何形状为________。
②已知立方氮化硼晶体中晶胞参数为a nm,阿伏加德罗常数值为NA,则该晶体的密度表达式为_________gcm3。
【答案】![]() 3 铝为金属晶体,金属键不强,熔点不高;晶体硼为原子晶体,原子间靠共价键结合,且共价键数量多,作用较强,因此其熔点高于铝 非极性 sp3 N C2H6 硼酸分子间通过氢键缔合,加热时部分氢键被破坏 正四面体
3 铝为金属晶体,金属键不强,熔点不高;晶体硼为原子晶体,原子间靠共价键结合,且共价键数量多,作用较强,因此其熔点高于铝 非极性 sp3 N C2H6 硼酸分子间通过氢键缔合,加热时部分氢键被破坏 正四面体 ![]()
【解析】
(1)B为5号元素,根据核外电子排布规律分析;
(2)结合晶体类型与物质熔点的关系分析;
(3)根据空间成键方式判断;
(4)根据元素原子的电负性分析作答;
(5)结合题意,根据氢键对物质沸点的影响效果作答;
(6)在氮化硼晶体中,N原子位于晶胞的8个顶点和6个面心,所以有:8×![]() +6×
+6×![]() =4个;B原子位于晶胞的内部,共4个,则一个晶胞中有4个N和4个B,结合几何关系计算。
=4个;B原子位于晶胞的内部,共4个,则一个晶胞中有4个N和4个B,结合几何关系计算。
(1)B原子核外电子排布为1s22s22p1,共占有3个不同的能级;价电子为2s22p1。
(2)铝为金属晶体,金属键不强,熔点不高;晶体硼为原子晶体,原子间靠共价键结合,且共价键数量多,作用较强,因此其熔点高于铝。
(3)Al2Cl6分子中正负电荷中心重合,则属于非极性分子;在Al2Cl6中每个铝原子和4个氯原子形成共价键,故Al原子采取sp3杂化。
(4)氨硼烷(NH3BH3)中,N和B的化合价均为3,“BH3”与“NH3”的化合价都是0,两者之间通过配位键相连,B的最外层有3个电子结合3个H原子,还缺少两个电子就达到稳定结构,而N结合3个H原子,还有1个孤电子对,所以N提供孤对电子而B提供空轨道形成配位键。与氨硼烷互为等电子体的微粒,必须具有相同的价电子数和原子数,C2H6与氨硼烷互为等电子体。
(5)在H3BO3分子间主要通过氢键相连,加热时部分氢键易被破坏,所以硼酸在冷水中的溶解度小而加热时溶解度增大。
(6)①在氮化硼晶体中,N原子位于晶胞的8个顶点和6个面心,所以有:8×![]() +6×
+6×![]() =4个;B原子位于晶胞的内部,共4个,则一个晶胞中有4个N和4个B。与N原子直接相连接的B原子构成的几何形状和与B原子直接相连接的N原子构成的几何形状一样,均为正四面体,其中N原子在体心,4个B原子在顶点。
=4个;B原子位于晶胞的内部,共4个,则一个晶胞中有4个N和4个B。与N原子直接相连接的B原子构成的几何形状和与B原子直接相连接的N原子构成的几何形状一样,均为正四面体,其中N原子在体心,4个B原子在顶点。
②晶胞的质量:m=ρ·V=![]() ×(11+14) g,故ρ=
×(11+14) g,故ρ=![]() ÷(a×107)3gcm3=
÷(a×107)3gcm3=![]() gcm3。
gcm3。