题目内容
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
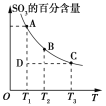
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答下列问题:
①2SO2(g)+O2(g)![]() 2SO3(g)的ΔH________0(填“>”或“<”)。
2SO3(g)的ΔH________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比为2︰1置于一体积不变的密闭容器中发生反应,能说明该反应已达到平衡的是________(填选项字母)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量分数不再变化
d.单位时间内转移4 mol电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
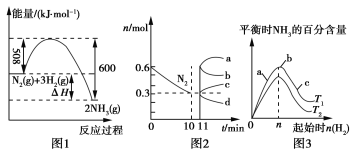
①该反应的平衡常数表达式为________,升高温度,平衡常数________(填“增大”“减小”或“不变”)。
②由图2信息,计算0~10 min内该反应的平均速率v(H2)________,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”)。
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________点,温度T1________T2(填“>”“=”或“<”)。
【答案】(13分,除标明外,每空2分)
(1)①<(1分) ②be
(2)①K=c2(NH3)/[c(N2)×c3(H2)](1分) 减小
②0.045 mol/(L·min) d
③c(1分) <
【解析】(1)①由题图可知,横轴代表温度,纵轴代表SO3的百分含量,随温度升高,SO3的百分含量减小,所以此反应的ΔH<0。②反应前后气体总质量不变,容器体积不变,所以密度不变不能说明反应已达到平衡,a错误;二氧化硫和三氧化硫的体积比保持不变说明已达反应平衡,b正确;体系中总质量不变,硫元素的质量不变,所以硫元素的质量分数不变不能说明反应已达平衡,c错误;单位时间内转移4 mol电子,同时消耗2 mol SO3,不能说明反应已达到平衡,d错误;此反应是一个反应前后气体分子总数不相等的反应,气体分子总数不变说明反应已达到平衡,e正确。
(2)①由反应的方程式得到平衡常数表达式:K=c2(NH3)/[c(N2)×c3(H2)],由图1可知,该反应的正反应为放热反应,所以升高温度,平衡常数减小。②0~10 min,N2的物质的量减小0.3 mol,则v(N2)==0.015 mol/(L·min),v(H2)=0.045 mol/(L·min)。压缩容器的体积为1 L,缩小体积即增大压强,平衡正向移动,氮气的物质的量逐渐减小,所以表示氮气物质的量变化的曲线为d。③起始时n(H2)越大,N2的转化率越高;起始时n(H2)一定时,温度越高,平衡时NH3的百分含量越低。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)该反应的平衡常数表达式K=_____________,△H_________0(填“>”、“<”或“=”)。
(2)要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.恒容加入H2加压
e.恒容加入惰性气体加压
f.分离出甲醇
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是_____(填字母)。
A.c(H2)减少B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
(4)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为__________,此时的温度为________。以CH3OH表示该过程的反应速率v(CH3OH)=_________mol /(L · min)。


