题目内容
5.设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )| A. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+个数为0.02NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 含有NA个氧原子的氧气在标准状况下的体积为22.4 L |
分析 A、求出二氧化硫的物质的量,然后根据二氧化硫为三原子分子来分析;
B、求出碳酸钠的物质的量,然后根据碳酸钠中含2mol钠离子来分析;
C、氧气和臭氧均由氧原子构成;
D、氧气为双原子分子.
解答 解:A、64g二氧化硫的物质的量为1mol,而二氧化硫为三原子分子,故1mol二氧化硫中含3NA个原子,故A正确;
B、1.06g碳酸钠的物质的量为0.01mol,而碳酸钠中含2mol钠离子,故0.01mol碳酸钠中含0.02NA个钠离子,故B正确;
C、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为2mol,个数为2NA个,故C正确;
D、氧气为双原子分子,故含NA个氧原子的氧气的物质的量为0.5mol,在标况下为11.2L,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
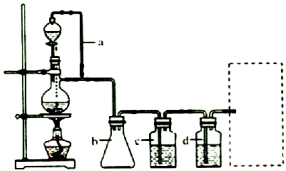
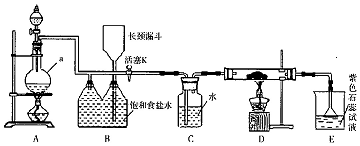
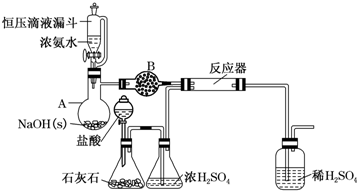
15.S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
①CS2+3Cl2$\frac{\underline{\;95-100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应;S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.
下表是几种物质的熔沸点,如图是反应装置图:
(1)利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是①(填写以上两种反应原理的数字序号).
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水CaCl2(或固体P2O5).
(3)D装置中冷凝管的作用是冷凝、回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)上图尾部装置不够完善,改进措施是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
(7)若A中消耗了26.1g MnO2,得到10.8g产品,本实验的产率是80%.
①CS2+3Cl2$\frac{\underline{\;95-100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应;S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.

下表是几种物质的熔沸点,如图是反应装置图:
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水CaCl2(或固体P2O5).
(3)D装置中冷凝管的作用是冷凝、回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)上图尾部装置不够完善,改进措施是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
(7)若A中消耗了26.1g MnO2,得到10.8g产品,本实验的产率是80%.
16.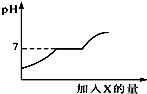 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
20.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量小 | |
| C. | 气体摩尔体积:甲<乙 | |
| D. | 甲的相对分子质量比乙的相对分子质量小 |
10.下列说法中,正确的是( )
| A. | 1 mol NO的质量是30g | |
| B. | 标准状况下,1 mol H2O的体积是22.4 L | |
| C. | 17 g NH3含有的氢原子总数为6.02×1023 | |
| D. | 0.1 mol Na2CO3中,Na+的物质的量为 0.1 mol |