题目内容
20.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量小 | |
| C. | 气体摩尔体积:甲<乙 | |
| D. | 甲的相对分子质量比乙的相对分子质量小 |
分析 同温同压下,体积之比等于物质的量之比,由等质量的甲、乙两种气体,且甲的密度大于乙的密度,则甲中的气体的体积小,以此来解答.
解答 解:同温同压下,体积之比等于物质的量之比,由等质量的甲、乙两种气体,且甲的密度大于乙的密度,则甲中的气体的体积小,
A.甲的体积小,物质的量小,则甲的分子数小,故A错误;
B.体积与物质的量成正比,则甲的物质的量少,故B正确;
C.相同状况下,气体的摩尔体积相同,故C错误;
D.相同质量时,甲的物质的量小,则甲的摩尔质量大,故D错误;
故选B.
点评 本题考查阿伏伽德罗定律及推论,注意体积、物质的量的关系及习题中的信息应用即可解答,选项A为解答的易错点,题目难度中等.

练习册系列答案
相关题目
10.下列有关化学用语的表示正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电子式: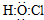 | |
| C. | 氮原子的结构示意图: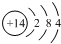 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
15.在恒温恒容的容器中,发生反应:H2(g)+CO(g)=C(s)+H2O(g).初始时加入平均相对分子质量为15的H2、CO 混合气,一段时间后测得气体的平均相对分子质量为16,下列说法正确的是( )
| A. | 反应前后气体的压强之比为2:1 | |
| B. | 反应前后气体的密度之比为15:16 | |
| C. | 此时CO的转化率为50% | |
| D. | 如果反应继续向正向进行,气体的平均相对分子质量将减小 |
5.设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+个数为0.02NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 含有NA个氧原子的氧气在标准状况下的体积为22.4 L |
12.在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2+9H2O反应中,氧化剂与还原剂物质的量之比是( )
| A. | 5:8 | B. | 5:4 | C. | 5:3 | D. | 3:5 |