题目内容
【题目】A为两种金属组成的合金,发生如图所示的变化: 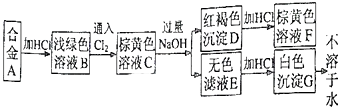
(1)合金A由和组成;
(2)写出下列变化的离子方程式: C→E;
D→F .
【答案】
(1)Fe;Al
(2)Al3++4OH﹣═AlO2﹣+2H2O;Fe(OH)3+3H+=Fe3++3H2O
【解析】解:含Fe2+溶液是浅绿色的,能被氯气氧化为Fe3+ , Al可以和盐酸反应得到可溶性的含有Al3+的盐,铝离子和过量的NaOH反应会生成偏铝酸钠的水溶液,向其中加盐酸会出现氢氧化铝沉淀, 所以合金是金属铁和铝的合金,B是氯化亚铁溶液,C是氯化铁溶液,D是氢氧化铁沉淀,E是偏铝酸钠溶液,G是氢氧化铝.(1)合金是金属铁和铝的合金,所以答案是:Fe;Al;(2)氯化铝和过量的氢氧化钠反应的离子方程式为:Al3++4OH﹣═AlO2﹣+2H2O,氢氧化铁溶于盐酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
所以答案是:Al3++4OH﹣═AlO2﹣+2H2O,Fe(OH)3+3H+=Fe3++3H2O.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目