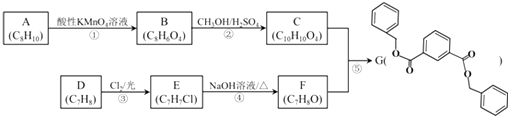
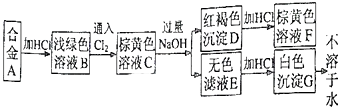
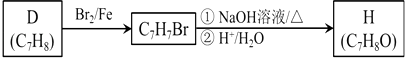题目内容
【题目】常温下,50mL pH=1的稀H2SO4和盐酸的混合液与50mL Ba(OH)2溶液相混合,充分反应后过滤,得0.466g沉淀,滤液的pH值变为13.求:
(1)原混合液中SO42﹣ 和Cl﹣的物质的量;
(2)Ba(OH)2溶液的物质的量浓度.
【答案】
(1)解:由原子守恒:n(BaSO4)=n(SO42﹣)= ![]() =0.002mol,
=0.002mol,
即c(SO42﹣)=0.04mol/L
n(Cl﹣)=n(H+)﹣2n(SO42﹣)=0.001mol
答:原混合液中SO42﹣ 和Cl﹣的物质的量分别为:0.002mol,0.001mol
(2)解:pH=13,pOH=1,n(OH﹣)=0.1 mol/L,未知浓度的Ba(OH)2溶液中
n(OH﹣)总=0.050L×0.1mol/l+0.1L×0.1mol/L=0.015 mol
Ba(OH)2的物质的量浓度= ![]() =0.15 mol/L
=0.15 mol/L
答:Ba(OH)2溶液的物质的量浓度为0.15mol/L
【解析】充分反应后滤液的pH=13,溶液中仍有Ba(OH)2剩余,混合酸反应完全.(1)n(SO42﹣)= ![]() =0.002 mol, n(Cl﹣)=0.1mol/L×0.050L﹣2×0.002mol=0.001 mol;(2)pH=13,pOH=1,n(OH﹣)=0.1 mol/L
=0.002 mol, n(Cl﹣)=0.1mol/L×0.050L﹣2×0.002mol=0.001 mol;(2)pH=13,pOH=1,n(OH﹣)=0.1 mol/L
未知浓度的Ba(OH)2溶液中n(OH﹣)总=0.050L×0.1mol/l+0.1L×0.1mol/L=0.015 mol
Ba(OH)2的物质的量浓度= ![]() =0.15 mol/L.
=0.15 mol/L.

 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】如图1为某加碘盐标签的一部分. 
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液.
步骤2:取一支50mL碱式滴定管,用bmolL﹣1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
编号 | 碱式滴定管读数 | 消耗体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
1 | 0 | 如图2 | |
2 | 0 | 23.98 | 23.98 |
3 | 0 | 24.02 | 24.02 |
(1)第一次读数为mL.
(2)滴定终点的判断方法 .
(3)经过计算,此碘盐碘元素的含量为mgkg﹣1(用含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏低的是 .
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)