题目内容
在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是( )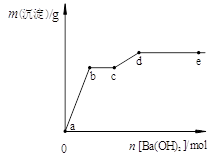
| A.a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B.b→c时发生的离子反应为:H+ + OH— → H2O |
| C.c→d时离子的物质的量:Ba2+可能大于Cl— |
| D.d→e时离子的物质的量:Ba2+一定大于OH— |
B
解析试题分析:往混合溶液中加Ba(OH)2溶液,开始阶段发生的反应为Ba2++SO42- +2H+ + 2OH— = BaSO4↓+ 2H2O,图像为a-b段;当SO42- 被完全沉淀时,还有2mol H+ ,所以继续滴加Ba(OH)2溶液,发生的反应为H+ + OH— = H2O,无沉淀产生,图像为b-c段,该阶段消耗Ba(OH)2 1mol;再继续滴加Ba(OH)2溶液,发生反应为Mg2++ 2OH— = Mg(OH)2↓,所以沉淀有增多,图像为c-d段,当镁离子完全被沉淀,则沉淀不再增多,图像保持d-e段趋势。所以正确的是B,选B。
考点:本题考查的是离子反应。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
在水溶液里或熔融状态下能导电的化合物是电解质。下列物质不属于电解质的是
| A.Fe | B.NaOH | C.H2SO4 | D.Na2SO4 |
下列叙述正确的是
| A.固体氯化钠不导电,所以氯化钠不是电解质 |
| B.铜丝能导电,所以铜是电解质 |
| C.氯化氢水溶液能导电,所以氯化氢是电解质 |
| D.SO3 溶于水能导电,所以 SO3 是电解质 |
下列各组离子在溶液中能大量共存的是
A.Na+、Al3+、Cl-、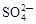 | B.Cu2+、Cl-、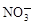 、OH- 、OH- |
C.Ca2+、Na+、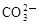 、 、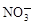 | D.H+、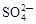 、 、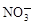 、OH- 、OH- |
能正确表示下列反应的离子反应方程式为
| A.NH4HCO3溶于过量的浓KOH溶液中:NH4++ OH-= NH3↑+ H2O |
| B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
| C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2="2" Fe3++2 Br2+6 Cl- |
| D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |
下列离子方程式书写正确的是( )
| A.向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失 2H++SiO32—=H2SiO3(胶体) |
B.用惰性电极电解MgCl2溶液:2Cl—+2H2O Cl2↑+H2↑+2OH— Cl2↑+H2↑+2OH— |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.5.6 g Fe与200 mL 2.0 mol/L HNO3溶液充分反应:3Fe + 2NO3—+ 8H+=3Fe2+ + 2NO↑ + 4H2O |
常温,下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1的溶液中: I-、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)="0.1" mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
下列各组中两种物质在溶液里的反应,可用同一离子方程式表示的是
| A.KCl+AgNO3;AlCl3+ AgNO3 |
| B.NaHCO3+H2SO4;Na2CO3+HCl |
| C.NaHCO3+NaOH;Ca(HCO3)+KOH |
| D.BaCl2+H2SO4;Ba(OH)2+H2SO4 |
下列各组离子在指定的溶液中不能大量共存的是
| A.滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42–、Cl– |
| B.1 mol·L–1的烧碱溶液中:S2–、SO32–、S2–、K+ |
| C.使淀粉碘化钾试纸变蓝的溶液中:Cs+、Ba2+、S2–、Cl– |
| D.含有大量HCO3–的澄清透明溶液中:K+、NH4+、Cl–、Na+ |