题目内容
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是
| A.IF5 + 3H2O = HIO3 +5HF |
| B.3IBr +2Fe = FeI3 + FeBr3 |
| C.BrCl的氧化性强于I2 |
| D.IBr可以与NaOH溶液反应生成2种盐 |
B
解析试题分析:可以根据化合价原理判断IF5中F为-1价,I为+5价,A、IF5 + 3H2O = HIO3 +5HF,正确;B、Fe3+与I—能发生氧化还原反应,错误;C、BrCl的氧化性介于Br2与Cl2之间,强于I2,正确;D、IBr与NaOH溶液反应生成NaBr,NaIO 2种盐,正确。
考点:根据卤素的性质来推测拟卤素的性质,考查学生的知识迁移能力。

下列方法中,不能用于实验室里制取氨气的是( )
| A.加热烧瓶中的浓氨水 |
| B.加热试管中的熟石灰和氯化铵固体的混合物 |
| C.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 |
| D.加热试管中的氯化铵固体,并将产生的气体通过装有碱石灰的干燥管 |
两种大气污染物NO2和SO2在一定条件下可发生如下反应:NO2 + SO2 NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
A. | B.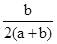 | C. | D.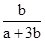 |
下列物质的使用不涉及化学变化的是
| A.明矾用作净水剂 | B.液氨用作制冷剂 |
| C.氢氟酸刻蚀玻璃 | D.生石灰作干燥剂 |
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是
① 铜片消耗完所需时间;② 反应生成的气体体积(标准状况);③ 反应中氧化剂得到的电子总数;④ 反应后溶液中铜离子的浓度
| A.①③ | B.②④ | C.③④ | D.只有① |
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A.原混合物中铜和铁各0.15 mol | B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 | D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
下列关于浓硝酸的叙述正确的是
| A.具有挥发性,因而浓硝酸略带有黄色 | B.具有不稳定性,实验室里应保存在棕色瓶中 |
| C.具有强氧化性,常温下可以溶解铝片 | D.具有酸性,实验室可以用它来制氢气 |
无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
| A.NH3、NO2、N2(体积比5∶16∶4) |
| B.NH3、NO、CO2(体积比5∶8∶12) |
| C.NH3、NO2、CO2 (体积比3∶8∶4) |
| D.NO、CO2、N2(体积比8∶12∶5) |
某同学通过系列实验探究硫及其化合物的性质,实验现象正确且能达到目的的是
| A.点燃硫磺.产生刺激性气味气体,该气体可以漂白纸浆 |
| B.向蔗糖中加入浓硫酸,蔗糖变黑色,说明浓硫酸具有强的吸水性 |
| C.将H2S气体通入CuSO4溶液生成CuS沉淀,说明H2S为强电解质 |
| D.将Al片加入浓硫酸中,反应剧烈,说明浓硫酸具有强的氧化性 |