题目内容
【题目】人工肾脏可采用电化学方法除去代谢产物中的尿素,其原理如图所示。
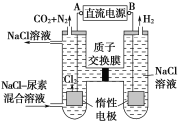
(1)电源的负极为__(填“A”或“B”)。
(2)阳极室中发生的反应依次为__、__。
(3)电解结束后,阴极室中溶液的pH与电解前相比将__(填“升高”“降低”或“不变”);若两极共收集到气体13.44L(标准状况下),则除去的尿素为__g(忽略气体的溶解)。
【答案】B 2Cl--2e-=Cl2↑ CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl 不变 7.2
【解析】
(1)根据原电池中的反应类型判断正负极;(2)根据电极反应中的反应物和产物及原电池原理书写电极反应式;(3)根据电极反应及电子转移守恒进行相关计算。
(1)由图可知,左室电极产物为CO2和N2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源的负极,故答案为:B;
(2)由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑ ;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl ,故答案为:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
(3)阴极反应为:6H2O+6e-=6OH-+6H2↑(或6H++6e-=3H2↑),阳极反应为2Cl--2e-=Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH恰好反应生成水,所以阴极室中电解前后溶液的pH不变;电解收集到的13.44L气体,物质的量为![]() ,由反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知(根据转移电子守恒分析,生成的气体物质的之比为n(Cl2):n(N2):n(CO2)=3:1:1),n(N2)=n(CO2)=0.6mol×
,由反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知(根据转移电子守恒分析,生成的气体物质的之比为n(Cl2):n(N2):n(CO2)=3:1:1),n(N2)=n(CO2)=0.6mol×![]() =0.12mol,可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]=0.12mol×60g/mol=7.2g,故答案为:不变;7.2。
=0.12mol,可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]=0.12mol×60g/mol=7.2g,故答案为:不变;7.2。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D