题目内容
(14分)甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
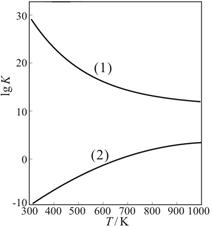
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
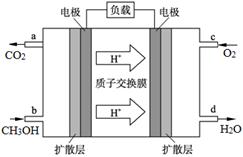
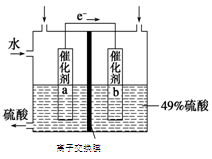
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。

(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。

共14分。每空2分。
(1)-719.5(2分) ab(2分)
(2)①I(1分) II(1分) ②II(2分)
(3)①4.57(2分)
②6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O(2分)
(4)CH3OH+H2O–6e-=CO2↑+6H+(2分)
(1)-719.5(2分) ab(2分)
(2)①I(1分) II(1分) ②II(2分)
(3)①4.57(2分)
②6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O(2分)
(4)CH3OH+H2O–6e-=CO2↑+6H+(2分)
试题分析:(1)由盖斯定律得2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH=(①×3+②×2)/2,将①②的代入上式中得所求ΔH=-719.45kJ/mol;利用太阳能或生物质能分解水制H2,需要开发高效光催化剂,使水易在太阳光的作用下分解,同时将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化,但二氧化碳及水资源的来源供应不是需要解决的技术问题,答案选ab;
(2)反应物中的原子尽可能的转化为生成物,原子的利用率越高,所以反应I的原子利用率高;反应II的化学平衡常数较大,说明反应进行的彻底程度较大,而且反应II是放热反应,所以从反应的焓变和平衡常数K值看,反应II制甲醛有利;
(3)①根据所给方程式可知2NH4+~4O2~2HNO3,1 g铵态氮元素转化为硝态氮元素时需氧的质量为2×32/14=4.57g,
②甲醇和NO3-反应转化为两种无毒气体,从元素守恒角度判断无毒气体是氮气和二氧化碳,另一种产物是水,离子方程式为6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
(4)燃料电池中燃料在电池的负极发生氧化反应,结合图中信息,甲醇被氧化为二氧化碳和氢离子,所以该电池的负极反应式为CH3OH+H2O–6e-=CO2↑+6H+

练习册系列答案
相关题目
 2NH3 + Q,下列叙述中正确的
2NH3 + Q,下列叙述中正确的 
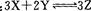
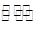 2 FeO(s)+CO(g)
2 FeO(s)+CO(g) H2+I2
H2+I2
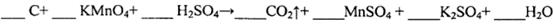
 ,得到如下两组数据:
,得到如下两组数据: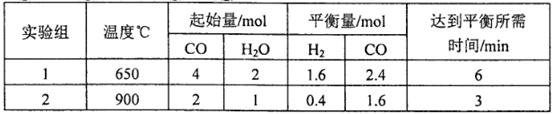
 ____________
____________ (填“<”,“>”,“=”)。
(填“<”,“>”,“=”)。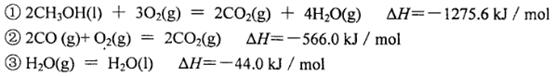
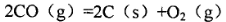
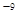 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10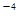 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。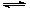 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
 Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。