题目内容
下列事实不能用勒夏特列原理解释的是 ( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率; |
| C.过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多。 |
| D.久制的氯水PH值变小。 |
C
试题分析:A.工业生产硫酸的过程中由于SO2转化为SO3的反应是可逆反应,若使用过量的氧气,即增大了反应物的浓度,根据平衡移动原理,增大反应物的浓度,可以是平衡正向移动,因此可以提高二氧化硫的转化率,正确;B.合成氨的反应是气体体积减小的放热反应,工厂通常采用20MPa~50MPa压强,即增大压强,结构平衡移动原理:增大压强,可以使平衡向气体气体减小的方向,即正反应方向移动,因此可以使更多的氮气、氢气合成氨气,因此就可以提高原料的利用率;正确;C.过氧化氢分解加二氧化锰作催化剂,只能提高化学反应速率,但是这与化学平衡的移动无关,错误;D.氯气与水的反应是可逆反应,若氯水久制,HClO发生分解,使平衡正向移动,溶液中的c(H+)增大,所以溶液的PH值变小。正确。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
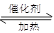 2SO3,下列判断正确的是
2SO3,下列判断正确的是 Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是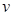 (H2O)=
(H2O)= 2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1
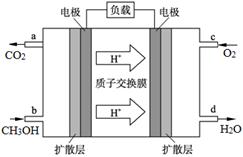
 2PbCrO4(s)+2H+(aq)△H<0
2PbCrO4(s)+2H+(aq)△H<0