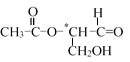题目内容
【题目】如图是用0.1 mol·L-1 NaOH溶液分别滴定20 mL浓度均为0.1 mol·L-1的不同一元酸的滴定曲线(图中曲线由上向下依次是氢氰酸、醋酸、氢氟酸、盐酸),下列说法错误的是
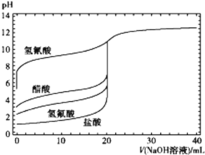
A.酸性:HF>CH3COOH>HCN
B.当加入10 mL NaOH溶液时,c(CN-)>c(CH3COO-)
C.用NaOH溶液滴定醋酸时,应用酚酞作指示剂不能使用甲基橙
D.随NaOH溶液滴入,CH3COOH溶液中水的电离程度先变大后变小
【答案】B
【解析】
A. 相同条件下,相同浓度的三种酸,溶液的pH:HF<CH3COOH<HCN,pH越小,酸性越强,所以酸性:HF>CH3COOH>HCN,故A正确;
B. HCN的酸性小于CH3COOH,相同浓度时,HCN的电离程度小,溶液中CN-的浓度小,所以溶液中c(CN-)<c(CH3COO-),故B错误;
C. NaOH与醋酸反应生成CH3COONa,溶液显碱性,应该选择在碱性条件下变色的指示剂,所以选择酚酞,故C正确;
D. 随NaOH溶液的滴入,CH3COOH溶液中氢离子浓度减小,对水的抑制程度减小,当氢氧化钠过量,NaOH会抑制水的电离,水的电离程度减小,所以CH3COOH溶液中水的电离程度先变大后变小,故D正确。
故答案为B。

【题目】下列各组物质中,不能按![]() (“→”表示一步完成)的关系相互转化的是 ( )
(“→”表示一步完成)的关系相互转化的是 ( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | Cl2 | NaClO | NaCl |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A.AB.BC.CD.D
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢