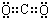题目内容
19.某同学想要从碘的饱和水溶液中萃取碘,关于该实验的说法中不正确的是( )| A. | 使用分液漏斗前应先检查其是否漏液 | |
| B. | 可以选用苯、汽油、酒精和四氯化碳为萃取剂 | |
| C. | 若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色 | |
| D. | 分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出 |
分析 A.有活塞或塞子的仪器需要检验是否漏水;
B.萃取剂的选择原则是:与水互不相溶,被萃取的物质在该溶剂中的溶解度比在水中的溶解度大,且跟萃取物不发生化学反应;
C.碘易溶于CCl4,溶液呈紫红色,密度比水大;
D.上层液体从上口倒出.
解答 解:A.容量瓶有瓶塞,配制过程中需要摇匀,所以使用前应检验是否漏液,故A正确;
B.酒精与水互溶,不能做萃取剂,故B错误;
C.碘易溶于CCl4,溶液呈紫红色,由于CCl4密度比水大,则层为无色下层为紫红色,故C正确;
D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以免两种液体相互污染,故D正确.
故选B.
点评 本题考查分液,难度不大,注意分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以免两种液体相互污染.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
10.下列说法正确的是( )
| A. | 在放热反应中,旧键断裂需要的能量比新键形成放出的能量多 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 一个化学反应的能量变化只与反应物的用量有关,与各物质的状态无关 |
7.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| B. | 标准状况下,2.24LCl2通入水中生成NA个HClO | |
| C. | 1.6gO2与O3组成的混合物中所含O原子数为0.1NA | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
14.在中和热测定的实验中不需要用到的仪器是( )
| A. | 量筒 | B. | 酒精灯 | C. | 温度计 | D. | 环形玻璃搅拌棒 |
4.能发生加成反应,也能发生取代反应,能使酸性高锰酸钾溶液褪色,同时也能使溴水因反应而褪色的( )
| A. | 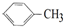 | B. | C6H12 | C. |  | D. |  |
11.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如图.对上述流程的判断正确的是( )
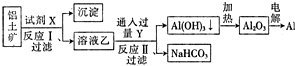

| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | 结合质子(H+)的能力由强到弱的顺序是AlO${\;}_{2}^{-}$>OH->CO${\;}_{3}^{2-}$ | |
| D. | 反应Ⅰ、Ⅱ均为氧化还原反应 |
9.下列叙述正确的是( )
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(SO42->c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 1.0×l0-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| D. | 常温下,1mLpH=1的盐酸与l00mL pH=11的NaOH溶液混合后,溶液的pH=7 |