题目内容
【题目】将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
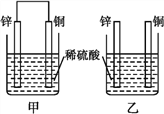
(1)下列说法中正确的是____(填序号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减小、乙中锌片质量减小 D.两烧杯中H+的浓度均减小
(2)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为____。
(3)当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L1。试确定原稀硫酸中c(H2SO4)=___________。
(4)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池总反应的化学方程式:________________________。
(5)以甲醇(CH3OH)为燃料的电池中,电解质溶液为酸性,负极的反应式为:_______________________,正极的反应式为:___________________________。
【答案】 BD 0.1NA 1mol/L 2Zn+Ag2O2+4KOH+2H2O=2K2Zn(OH)4+2Ag 2CH3OH-12e﹣+2H2O=12H﹢+2CO2↑ 3O2+12e﹣+12H﹢=6H2O
【解析】(1)A.甲构成原电池,化学能转变为电能,乙不能,A错误;B.乙中锌与稀硫酸之间反应,铜片上没有明显变化,B正确;C.甲中锌是负极,铜是正极,正极上氢离子放电,所以铜片质量不变,乙中锌片质量减小,C错误;D.两烧杯中均消耗氢离子,H+的浓度均减小,D正确,答案选BD。(2)当甲中产生1.12 L(标准状况)气体时,氢气的物质的量是0.05mol,所以理论上通过导线的电子数目为0.1NA。(3)当乙中产生1.12 L(标准状况)气体时,氢气的物质的量是0.05mol,消耗硫酸是0.05mol。将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L1,氢离子是0.1mol,则剩余硫酸的物质的量是0.05mol,所以原稀硫酸中c(H2SO4)=0.1mol÷0.1L=1mol/L;(4)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,因此该电池总反应的化学方程式为2Zn+Ag2O2+4KOH+2H2O=2K2Zn(OH)4+2Ag。(5)以甲醇(CH3OH)为燃料的电池中,电解质溶液为酸性,负极发生甲醇失去电子的氧化反应,负极的反应式为2CH3OH-12e﹣+2H2O=12H﹢+2CO2↑,正极发生氧气得到电子的还原反应,正极的反应式为3O2+12e﹣+12H﹢=6H2O。

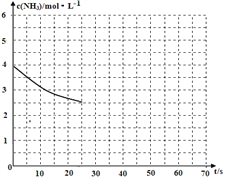
【题目】为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)所测土壤的酸碱性如何?
(2)所用氨水的pH和c(OH﹣)分别为多少?
(3)为使该滤液呈中性,所加入氨水的恰当体积是多少?