题目内容
【题目】下列关于各图的说法中正确的是
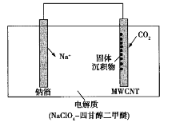
A.  ①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
B.  ②中待镀铁制品应与电源正极相连
②中待镀铁制品应与电源正极相连
C.  ③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
D.  ④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
【答案】D
【解析】
A.①装置是电解池,铁是活泼金属作阳极,由于阳极上是活性电极,故Cl-不放电,即阳极不能生成氯气,湿润淀粉-KI试纸不会变蓝色,A错误;
B.②装置中待镀制品上要有Cu2+放电析出铜,镀件应和电源负极相连,作电解池的阴极,B错误;
C.③装置是电解池,为了保护钢铁闸门不被腐蚀,要与外接电源的负极连接,作阴极,因此该方法叫外接电源的阴极保护法,C错误;
D. Cl2与水反应产生酸性物质,能和NaOH在溶液中反应反应。而Cl2在阳极生成,NaOH在阴极生成,④装置中的离子交换膜只允许Na+等阳离子通过,Cl2分子不能通过,就可以避免生成的Cl2与NaOH溶液反应,D正确;
故合理选项是D。

 名校课堂系列答案
名校课堂系列答案【题目】在2 L密闭容器中,800 ℃时,反应2NO+O2![]() 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,
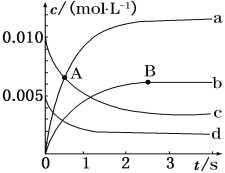
A点处,v(正)___________v(逆), A点正反应速率_________B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________。用NO2表示从0~2 s内该反应的平均速率v=____________________________。
(3) 能使该反应的反应速率增大的是____________。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)