题目内容
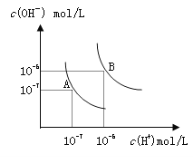
【题目】在某温度时,将n mol/L的氨水滴入10 mL1.0 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. 水的电离程度:b﹥a﹥c﹥d
C. b点:c(NH4+)﹥c(Cl-)﹥c(H+)﹥c(OH-)
D. 25℃时NH4Cl水解平衡常数为(n-1)×10-7(用n表示)
【答案】D
【解析】
A.根据图象可知,a点时溶液温度小于25℃,则水的离子积小于1.0×10-14(mol/L)2;
B.b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,NH4+水解促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C.该关系c(NH4+)>c(Cl-)>c(H+)>c(OH-)不满足电荷守恒;
D.25℃时溶液的pH=7,则c(H+)= c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-0.5)mol/L,然后结合铵根离子的水解平衡常数表达式计算。
A.水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14mol2L-2,A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,NH4+水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,B错误;
C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7mol/L,c(Cl-)=c(NH4+)=0.5mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:K=![]() =(n-1)×10-7,D正确;
=(n-1)×10-7,D正确;
故合理选项是D。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
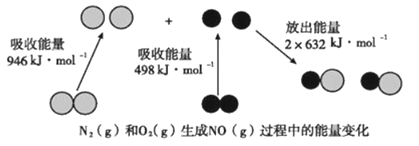
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3