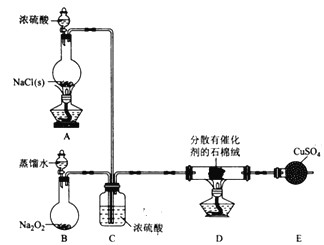
题目内容
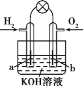
【题目】在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)本实验中制取次氯酸钠的离子方程式是_______________________。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为___________色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | ___________________________ |
然后溶液从无色逐渐变为_________色 | ____________________________ |
【答案】分液漏斗 B Cl2+2OH—===Cl—+ClO—+H2O 红色 生成的HClO有漂白性 黄绿 Cl2溶于水呈黄绿色
【解析】
①为反应制取氯气,②为氯气和氢氧化钾反应生成氯酸钾,③为氯气和氢氧化钠反应生成次氯酸钠,④为氯气与水反应生成盐酸和次氯酸,加入石蕊先变红后褪色,⑤为尾气处理,应用碱溶液吸收。
(1)制取氯气时用分液漏斗向烧瓶中加入浓盐酸,为了除去氯气中氯化氢,应选用饱和食盐水,故选B。 (2)氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,离子方程式为:Cl2+2OH—=Cl—+ClO—+H2O ; (3)氯气和水反应生成盐酸能使石蕊变红色;反应生成的HClO有漂白性,溶液变为无色。随着通入的氯气的量的增加,水中的氯气的量增加,水溶液变为黄绿色。