题目内容
【题目】CO2是一种常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。
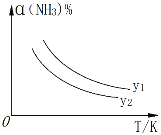
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH_____0(填“>”、“<”或“=”,下同),若y表示压强,则y1_______y2 , 若y表示反应开始时的水碳比[n(NH3)/n(CO2)],则y1_______y2。
(2)t℃时,若向容积为2L的密闭容器中加入3molNH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将__________(填“增大”、“减小”或“不变”)。
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为________________。
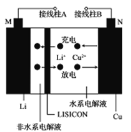
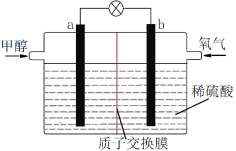
(4)下图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应式为________________________,当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。
【答案】< > < 减小 CO2(g) +3H2(g)=CH3OH(l) +H2O(l) △H=-130.9kJ/mol CH3OH +H2O-6e- =CO2+6H+ 12
【解析】
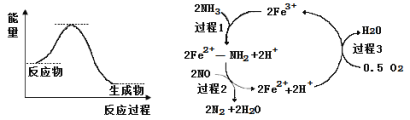
Ⅰ.(1)根据图示,升高温度,NH3转化率减小,平衡逆向移动;2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),正反应气体物质的量减小,加压平衡正向移动,氨气的转化率增大;增大NH3的浓度,NH3的转化率减小;(2)利用“三段式”计算平衡常数,根据
CO(NH2)2(s)+H2O(g),正反应气体物质的量减小,加压平衡正向移动,氨气的转化率增大;增大NH3的浓度,NH3的转化率减小;(2)利用“三段式”计算平衡常数,根据![]() 的关系判断平衡移动方向;Ⅱ.(3)由H2(g)和甲醇的燃烧热分别为285.8 kJ·mol-1、726.5kJ·mol-1,可知二者燃烧的热方程式分别为:H2(g)+1/2O2(g)=H20(l) ΔH=-285.8 kJ/mol ①;CH3OH (l)+3/2O2(g)=CO2(g)+2H20(l) ΔH=-726.5kJ·mol-1 ②,根据盖斯定律书写CO2与H2反应产生液态甲醇与液态水的热化学方程式;(4)电极a是负极,甲醇失电子生成二氧化碳和氢离子;当电池中有1mol e-发生转移时,a极消耗
的关系判断平衡移动方向;Ⅱ.(3)由H2(g)和甲醇的燃烧热分别为285.8 kJ·mol-1、726.5kJ·mol-1,可知二者燃烧的热方程式分别为:H2(g)+1/2O2(g)=H20(l) ΔH=-285.8 kJ/mol ①;CH3OH (l)+3/2O2(g)=CO2(g)+2H20(l) ΔH=-726.5kJ·mol-1 ②,根据盖斯定律书写CO2与H2反应产生液态甲醇与液态水的热化学方程式;(4)电极a是负极,甲醇失电子生成二氧化碳和氢离子;当电池中有1mol e-发生转移时,a极消耗![]() mol水,b极生成0.5mol水。
mol水,b极生成0.5mol水。
Ⅰ.(1)根据图示,升高温度,NH3转化率减小,平衡逆向移动,所以正反应放热,ΔH<0;2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),正反应气体物质的量减小,加压平衡正向移动,氨气的转化率增大;同温下,压强为y1时氨气转化率大于y2,所以y1>y2;增大NH3的浓度,NH3的转化率减小,水碳比[n(NH3)/n(CO2)]为y1时氨气转化率大于y2,所以y1<y2;
CO(NH2)2(s)+H2O(g),正反应气体物质的量减小,加压平衡正向移动,氨气的转化率增大;同温下,压强为y1时氨气转化率大于y2,所以y1>y2;增大NH3的浓度,NH3的转化率减小,水碳比[n(NH3)/n(CO2)]为y1时氨气转化率大于y2,所以y1<y2;
(2)2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
开始 1.5 0.5 0
转化 2x x x
平衡 1.5-2x 0.5-x x
![]()
x=0.25
K=![]() ,再向该容器中加入0.5molCO2和1molH2O,
,再向该容器中加入0.5molCO2和1molH2O,![]() >K,平衡逆向移动,NH3的转化率将减小;
>K,平衡逆向移动,NH3的转化率将减小;
Ⅱ.(3)由H2(g)和甲醇的燃烧热分别为285.8 kJ·mol-1、726.5kJ·mol-1可知,二者燃烧的方程式分别为:H2(g)+1/2O2(g)=H20(l) ΔH=-285.8 kJ/mol ①;CH3OH (l)+3/2O2(g)=CO2(g)+2H20(l) ΔH=-726.5kJ·mol-1 ②,根据盖斯定律①×3-②得CO2(g) +3H2(g)=CH3OH(l) +H2O(l) △H=-130.9kJ/mol;
(4)电极a是负极,甲醇失电子生成二氧化碳和氢离子,电极a上发生的电极反应式为CH3OH +H2O-6e- =CO2+6H+;当电池中有1mol e-发生转移时,a极消耗![]() mol水,b极生成0.5mol水,所以左右两侧溶液的质量之差为12g。
mol水,b极生成0.5mol水,所以左右两侧溶液的质量之差为12g。

【题目】在2 L密闭容器中,800 ℃时,反应2NO+O2![]() 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,
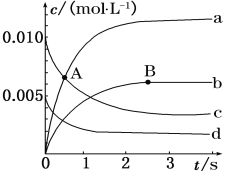
A点处,v(正)___________v(逆), A点正反应速率_________B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________。用NO2表示从0~2 s内该反应的平均速率v=____________________________。
(3) 能使该反应的反应速率增大的是____________。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)