题目内容
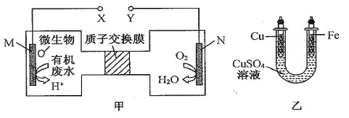
【题目】绿水青山就是金山银山,保护环境人人有责。直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A. c(Na+)=2c(SO32-)+c(HSO3-)
B .c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C. c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)氮的氢化物之一肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液,负极的电极反应式是_______________,若使用该电池做电源,惰性电极电解500mL 1mol/L的CuSO4溶液,一段时间后溶液的PH=1,消耗的N2H4质量为_________g。
【答案】酸 > Na2SO4 AB N2H4-4e-+4OH-=N2↑+2H2O 0.4
【解析】
(1)Na2SO3为强碱弱酸盐,在溶液中水解,使溶液呈碱性,由表给数据n(SO32—):n(HSO3—)=1:1时,溶液PH=7.2可知,NaHSO3溶液显酸性;
(2)Na2SO3为强碱弱酸盐,在溶液中水解,促进水电离,氢氧化钠是碱,在溶液中电离出氢氧根离子,抑制水电离;
(3)将pH=8.2的吸收液蒸干时,亚硫酸氢钠受热分解生成亚硫酸钠,亚硫酸钠被空气中氧气氧化生成硫酸钠;
(4)当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度;
(5)肼燃料电池中,燃料肼为负极,碱性条件下,肼在负极失电子发生氧化反应生成氮气和水,电极反应式为N2H4-4e-+4OH-=N2↑+2H2O;若使用该电池做电源,惰性电极电解500mL 1mol/L的CuSO4溶液,阳极上水失电子发生氧化反应生成氧气,破坏水的电离平衡,使溶液呈酸性,由电极反应式建立氢离子和肼的关系式求解可得。
(1)Na2SO3为强碱弱酸盐,在溶液中水解,使溶液呈碱性,由表给数据n(SO32—):n(HSO3—)=1:1时,溶液pH=7.2可知,NaHSO3溶液显酸性,故答案为:酸;
(2)Na2SO3为强碱弱酸盐,在溶液中水解,促进水电离,氢氧化钠是碱,在溶液中电离出氢氧根离子,抑制水电离,则pH=8.2的吸收液中由水电离出的c(OH-)大于0.1molL-1NaOH溶液中由水电离出来的c(OH-),故答案为:>;
(3)将pH=8.2的吸收液蒸干时,亚硫酸氢钠受热分解生成亚硫酸钠,亚硫酸钠被空气中氧气氧化生成硫酸钠,则蒸干得到固体的主要成分是硫酸钠,故答案为:Na2SO4;
(4)当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度;
A、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故正确;
B、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故正确;
C、溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故错误;
AB正确,故答案为:AB;
(5)肼燃料电池中,燃料肼为负极,碱性条件下,肼在负极失电子发生氧化反应生成氮气和水,电极反应式为N2H4-4e-+4OH-=N2↑+2H2O;若使用该电池做电源,惰性电极电解500mL 1mol/L的CuSO4溶液,阳极上水失电子发生氧化反应生成氧气,破坏水的电离平衡,使溶液呈酸性,电极反应式为2H2O—4e—=4H+十O2↑,由电极反应式可知氢离子和肼的关系式为N2H4—4e-—4H+,当溶液的PH=1时,溶液中氢离子的物质的量为0.05mol,则肼的质量为0.05mol×![]() ×32g/mol=0.4g,故答案为:N2H4-4e-+4OH-=N2↑+2H2O;0.4。
×32g/mol=0.4g,故答案为:N2H4-4e-+4OH-=N2↑+2H2O;0.4。

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.在![]() 内,Ⅰ中M的分解速率为
内,Ⅰ中M的分解速率为![]()
B.水样酸性越强,M的分解速率越快
C.在![]() 内,Ⅲ中M的分解百分率比Ⅱ大
内,Ⅲ中M的分解百分率比Ⅱ大
D.由于![]() 存在,Ⅳ中M的分解速率比Ⅰ快
存在,Ⅳ中M的分解速率比Ⅰ快