题目内容
(12分)已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。请回答以下问题:
(1)A分子的空间构型为 ;Y在周期表中的位置 ;
(2)写出气体D通入水中的化学反应方程 式________________________;&科&(3)E具有不稳定性,因此实验室中保存E的方法是 ;
式________________________;&科&(3)E具有不稳定性,因此实验室中保存E的方法是 ;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式: ,当反应中转移的电子为3mol时,被氧化的A在标准状况下的体积为 L。
(1)A分子的空间构型为 ;Y在周期表中的位置 ;
(2)写出气体D通入水中的化学反应方程
 式________________________;&科&(3)E具有不稳定性,因此实验室中保存E的方法是 ;
式________________________;&科&(3)E具有不稳定性,因此实验室中保存E的方法是 ;(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式: ,当反应中转移的电子为3mol时,被氧化的A在标准状况下的体积为 L。
(12分)(1)三角锥形;第2周期第VA族 ;
(2) 3NO2+H2O =" " NO + 2 HNO3
(3)贮存在棕色瓶中,置于冷暗处
(4)8NH3+3Cl2=6NH4Cl+N2;22.4L(每空2分)
(2) 3NO2+H2O =" " NO + 2 HNO3
(3)贮存在棕色瓶中,置于冷暗处
(4)8NH3+3Cl2=6NH4Cl+N2;22.4L(每空2分)
略

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目

 (2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。 K2SO4+ I2+ H2O
K2SO4+ I2+ H2O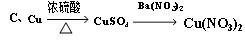
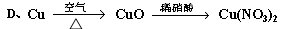
 混合气体在标准状况下的体积为5.6L。请回答:
混合气体在标准状况下的体积为5.6L。请回答: 浓度。
浓度。 学方程式为 ;
学方程式为 ;
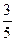 ,则混合气体中N2与NO2的体积比是
,则混合气体中N2与NO2的体积比是