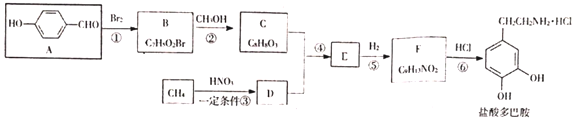
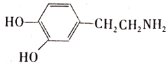
题目内容
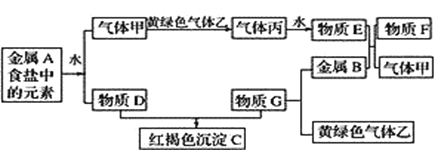
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子,某同学对该溶液进行了如下实验:

下列判断错误的是
A. 气体甲可能是混合物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. 白色沉淀乙的主要成分是氢氧化铝
D. K+、AlO2-和SiO32-一定存在于溶液X中
【答案】B
【解析】
向混合溶液中加入过量的盐酸,有气体生成,可能是CO2或者是SO2,或者均有,则溶液中不存在Mg2+和Al3+,因为会与SO32-、CO32-发生反应而不能大量共存。有沉淀甲生成,在溶液中含有SiO32-,生成硅酸沉淀。加入过量的氨水,生成沉淀,则只有AlO2-与过量的盐酸,生成的Al3+,与氨水反应生成氢氧化铝,由于电荷守恒,一定存在K+。
A.气体甲可能为CO2或者SO2,也可能两个气体成分都有,A项正确,不符合题意;
B.沉淀甲只有硅酸,SiO32-与Mg2+不能大量共存,B项错误,符合题意;
C. AlO2-在过量的盐酸作用下生成Al3+,Al3++3NH3·H2O =Al(OH)3 ↓+ 3NH4+,C项正确,不符合题意;
D.根据分析,D项正确,不符合题意;
本题答案选B。

【题目】实验室用如图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
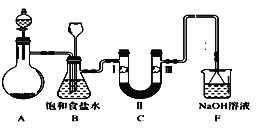
(1)整套装置装配完毕后,首先进行的操作是___,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为____。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为___mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是___。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是____(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)向品红溶液中同时通入氯气和二氧化硫(按物质的量之比1:1),观察到的现象是___。用化学方程式解释一下原因___。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式___。