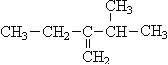题目内容
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
已知:

该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是① →_____→ → → ⑤。
①检查装置的气密性后加入药品 ②熄灭酒精灯,冷却
③在“气体入口”处通干燥HCl ④点燃酒精灯,加热
⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_________。
(4)装置D中发生反应的离子方程式是___________________________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是____________________________________________。
②若杂质是CuO,则产生的原因是________________________________________________。
(6)若m克CuCl2·2H2O全部转化为CuO(铜元素无损耗),则固体质量减少_____________克(用含m的式子表示)
【答案】 干燥管 3 → 4→ 2 先变红,后褪色 Cl2+2OH—→ClO-+Cl-+H2O 加热时间不足或温度偏低 通入HCl的量不足 91m/171
【解析】本题实验方案设计的评价,(1)仪器X为(球形)干燥管;(2)本实验有气体参与反应,因此首先检验装置的气密性,根据流程CuCl2·2H2O在HCl气流中加热,因此先通一段时间的HCl,让CuCl2·2H2O处于HCl氛围中,让然后点燃酒精灯,加热,反应结束后,熄灭酒精灯,冷却,让固体在N2的氛围中冷却,因此顺序是①→③→④→②→⑤;(3)观察到B中有白色变为蓝色,说明产生水,流程的目的得到CuCl,根据流程除得到CuCl外还有Cl2,Cl2+H2O![]() HCl+HClO,Cl2使湿润蓝色石蕊试纸线变蓝后褪色;(4)装置D的目的是吸收Cl2,防止污染空气,其离子反应方程式为Cl2+2OH-=Cl-+ClO-+H2O;(5)①根据流程温度高于300℃时,CuCl2才分解,若杂质是CuCl2,说明温度偏低或加热时间不足;②根据流程图,不在HCl氛围中,加热CuCl2·2H2O,得到Cu2(OH)2Cl,然后加热到200℃,得到CuO,因此杂质是CuO的原因是通入HCl的量不足;(7)全部转化成CuO,Cu元素无损耗,因此根据铜元素守恒,CuO的质量为80m/171g,则固体质量减少(m-80m/171)g=91m/171。
HCl+HClO,Cl2使湿润蓝色石蕊试纸线变蓝后褪色;(4)装置D的目的是吸收Cl2,防止污染空气,其离子反应方程式为Cl2+2OH-=Cl-+ClO-+H2O;(5)①根据流程温度高于300℃时,CuCl2才分解,若杂质是CuCl2,说明温度偏低或加热时间不足;②根据流程图,不在HCl氛围中,加热CuCl2·2H2O,得到Cu2(OH)2Cl,然后加热到200℃,得到CuO,因此杂质是CuO的原因是通入HCl的量不足;(7)全部转化成CuO,Cu元素无损耗,因此根据铜元素守恒,CuO的质量为80m/171g,则固体质量减少(m-80m/171)g=91m/171。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案