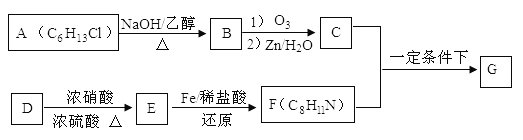
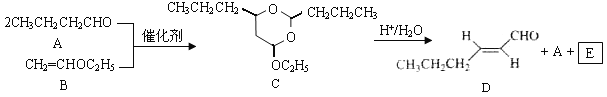
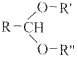
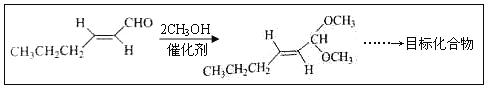
题目内容
【题目】将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极。甲,乙,丙三个装置中电解前后溶液的体积都是500mL。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。下列说法不正确的是( )

A.电源B 极的名称是负极,丁中Y极附近颜色变深
B.乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度
C.设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L
D.甲装置中电解反应的总化学方程式是: CuSO4+Fe![]() Cu+ FeSO4
Cu+ FeSO4
【答案】B
【解析】
试题分析:A、根据题意知电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极氢离子放电,溶液呈碱性,F极为电解池的阴极,B为电源的负极,氢氧化铁胶体胶粒带正电,向阴极移动,则丁中Y极附近颜色变深,正确;B、乙装置中电解总反应为2Cl- + 2H2O ![]() H2↑ + Cl2↑ + 2OH-,电解一段时间后,通入氯化氢气体才可以食盐水恢复原来的浓度,错误;C、根据反应2Cl- + 2H2O
H2↑ + Cl2↑ + 2OH-,电解一段时间后,通入氯化氢气体才可以食盐水恢复原来的浓度,错误;C、根据反应2Cl- + 2H2O ![]() H2↑ + Cl2↑ + 2OH-当乙池所产生气体的体积为4.48L(标准状况)时,转移电子的物质的量为0.2mol,由电子守恒结合反应CuSO4+Fe
H2↑ + Cl2↑ + 2OH-当乙池所产生气体的体积为4.48L(标准状况)时,转移电子的物质的量为0.2mol,由电子守恒结合反应CuSO4+Fe![]() Cu+ FeSO4知生成硫酸亚铁的物质的量为0.1mol,物质的物质的量浓度为0.2mol/L,正确;D、甲装置中C为铁电极,作电解池的阳极,电解反应的总化学方程式是: CuSO4+Fe
Cu+ FeSO4知生成硫酸亚铁的物质的量为0.1mol,物质的物质的量浓度为0.2mol/L,正确;D、甲装置中C为铁电极,作电解池的阳极,电解反应的总化学方程式是: CuSO4+Fe![]() Cu+ FeSO4,正确。
Cu+ FeSO4,正确。

【题目】(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJmol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是_____________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值______(填偏大、偏小、无影响)

(3)实验室用50mL 0.50molL-1盐酸、50mL 0.55molL-1 NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)