��Ŀ����
����Ŀ����ͭ��CuFeS2������ͭ������Ҫ�����Ұ������ױ����Ϊ�ƽ��ֳ����˽�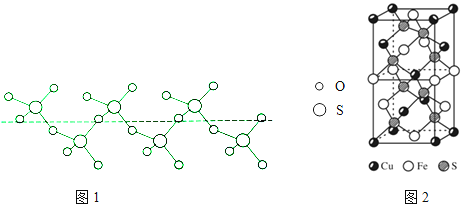
��1����ұ����ͭ��Ĺ����У�������Cu2O��Cu2S��Ӧ����Cu���ʣ���Ӧ�Ļ�ѧ����ʽ��
��2��Sλ�����ڱ��С� �壬����Ԫ���⻯���У�H2Te��H2S�е�ߵ�ԭ���� ��H2O��H2Te�е�ߵ�ԭ����
��3��S��+4��+6���ּ�̬��������ش��������⣺
�����й�����̬SO3��SO2��˵���У���ȷ���ǡ� ����
A������ԭ�ӵļ۲���Ӷ���Ŀ��� B�����Ǽ��Է���
C������ԭ�ӵŶԵ�����Ŀ��� D�������м��Լ�
�ڽ���Һ̬SO3��ȴ��289.8Kʱ���̵õ�һ������״�����ṹ�Ĺ��壬��ṹ��ͼ1���˹�̬SO3��Sԭ�ӵ��ӻ���������ǡ�
��4��Cu��+1��+2���ּ�̬�Ļ�����ش��������⣺
��Cu+�ļ۲�����Ų�Ϊ�� ����Cu2+�С� ����δ�ɶԵ��ӣ�
�����Ƶ�Cu��OH��2�ܹ��ܽ��ڹ���Ũ����Һ�У���Ӧ�����ӷ���ʽ�ǡ�
��5��CuFeS2�ľ�����ͼ2��ʾ����������a=0.524nm��c=1.032nm��CuFeS2�ľ�����ÿ��Cuԭ���롡 ����Sԭ����������ʽ���㾧���ܶ� ��=�� �� gcm��3 ��
���𰸡�
��1��2Cu2O+Cu2S![]() 6Cu+SO2��
6Cu+SO2��
��2����A�����߾�Ϊ���Ӿ����ҽṹ���ƣ�H2Te��Է���������H2S���Ӽ���������ǿ�����߾�Ϊ���Ӿ��壬H2O�����д������
��3��AD��sp3
��4��3d10��1��Cu��OH��2+2OH��=[Cu��OH��4]2����4��![]() ?
?
����������1��Cu2O��Cu2S��Ӧ����Cu���ʣ������ɶ�������ӦΪ2Cu2O+Cu2S![]() 6Cu+SO2�������Դ��ǣ�2Cu2O+Cu2S
6Cu+SO2�������Դ��ǣ�2Cu2O+Cu2S![]() 6Cu+SO2����
6Cu+SO2����
��2��S��ԭ�ӽṹ��3�����Ӳ㣬����������Ϊ6��λ�ڵڢ�A�壬H2Te��H2S����Է���������ķе�ߣ���H2Te�е�ߣ�H2O��H2Te�е�ߵ�ԭ�������߾�Ϊ���Ӿ��壬H2O�����д��������
���Դ��ǣ���A�����߾�Ϊ���Ӿ����ҽṹ���ƣ�H2Te��Է���������H2S���Ӽ���������ǿ�����߾�Ϊ���Ӿ��壬H2O�����д��������
��3����SO3�м۵��Ӷ�Ϊ3��û�й¶Ե��ӣ�Ϊƽ�������Σ���SO2�м۵�����Ϊ3���¶Ե�����Ϊ1��ΪV�ͣ���
A������ԭ�ӵļ۲���Ӷ���Ŀ��ȣ���A��ȷ��
B�����������ǷǼ��Է��ӣ���B����
C������ԭ�ӵŶԵ�����Ŀ���ȣ���C����
D��������S��O֮��ļ��Լ�����D��ȷ��
���Դ��ǣ�AD��
��ͼ1�й�̬SO3��Sԭ���γ�4�����۵��������ӻ����������sp3 �� ���Դ��ǣ�sp3��
��4����Cu��ԭ������Ϊ29���۵���Ϊ3d104s1 �� Cu+�ļ۲�����Ų�Ϊ3d10 �� Cu2+��3d�������9�����ӣ�ֻ��1�������ӣ����Դ��ǣ�3d10��1��
�����Ƶ�Cu��OH��2�ܹ��ܽ��ڹ���Ũ����Һ�����������ӣ���Ӧ�����ӷ���ʽ��ΪCu��OH��2+2OH��=[Cu��OH��4]2�� �� ���Դ��ǣ�Cu��OH��2+2OH��=[Cu��OH��4]2����
��5����������Cu��2��S������������ÿ��Cuԭ����4��S������8��S�������ڣ��ɻ�ѧʽΪCuFeS2 �� ��������Ϊ![]() �� ��������a=0.524nm��c=1.032nm�����Ϊ��0.524��10��7cm��2��1.032��10��7cm����=
�� ��������a=0.524nm��c=1.032nm�������0.524��10��7cm��2��1.032��10��7cm����=![]() =
=![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�4��![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�