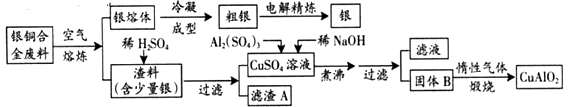
��Ŀ����
����Ŀ��Fe2+��Fe3+��O22����CN����F�����л����ӵ��γɵĻ�������й㷺��Ӧ�ã� 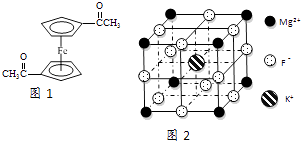
��1��C��N��Oԭ�ӵĵ�һ�������ɴ�С��˳����
��2��Fe2+��̬��������Ų�ʽΪ ��
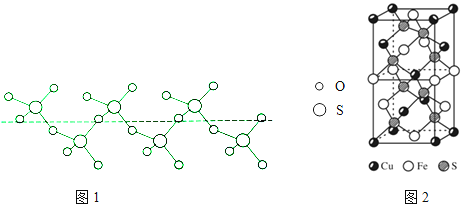
��3����������ï���dz������Ϳ��������ṹ��ͼ1��ʾ����������̼ԭ�ӵ��ӻ���ʽ�� ��
��4�������K3Fe��CN��6�����ڵ��Ӵ������������������廥Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ �� ��֪��CN��2��ֱ���ͷ��ӣ������жԳ��ԣ���CN��2�Цм��ͦҼ��ĸ�����Ϊ ��
��5��F����������Fe3+�γ�[FeF6]3�� �� ��������Mg2+��K+�γ�һ��������ϵ�����Ӿ��壬�˾���Ӧ���ڼ������ṹ��ͼ2��ʾ���þ���Ļ�ѧʽΪ ��
���𰸡�
��1��N��O��C
��2��1s22s22p63s23p63d6
��3��sp2��sp3
��4��CO��N2|4��3
��5��KMgF3
���������⣺��1��ͬһ����Ԫ�أ�Ԫ�صĵ�һ����������ԭ������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�����C��N��O����Ԫ�صĵ�һ���������ɴ�С��˳����N��O��C��
���Դ��ǣ�N��O��C����2������26��Ԫ�أ���ԭ�Ӻ�����26�����ӣ���������Ų�ʽΪ��1s22s22p63s23p63d64s2��ʧȥ2�����ӱ��Fe2+�����̬��������Ų�ʽ��1s22s22p63s23p63d6��
���Դ��ǣ�1s22s22p63s23p63d6����3��������Cԭ����̼̼˫����̼̼������ʽ���ڣ���̼ԭ�ӵ��ӻ���ʽ��sp2��sp3��
���Դ��ǣ�sp2��sp3����4��CN���к�������ԭ���Ҽ۵�������10��������CN����Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽ��CO��N2��
��CN��2��ֱ���ͷ��ӣ����жԳ��ԣ��ṹʽΪ��N��C��C��N��1��������1���Ҽ���1�������к���1���Ҽ���2���м������ԣ�CN��2�Цм��ͦҼ��ĸ�����Ϊ4��3��
���Դ��ǣ�CO��N2��4��3����5��������F��������Ŀ=12�� ![]() =3��Mg2+������Ŀ=8��
=3��Mg2+������Ŀ=8�� ![]() =1��K+������Ŀ=1���ʾ��廯ѧʽΪ��KMgF3��
=1��K+������Ŀ=1���ʾ��廯ѧʽΪ��KMgF3��
���Դ��ǣ�KMgF3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��(1)Ϊ�˼���ͳ�ȥ�±��еĸ�������(�������Ϊ����)����Ӣ���ѡ���ʵ��ļ����Լ����Ӣ���ѡ���ʵ��ij����Լ�������ѡ�Ĵ�����ĸ������Ӧ�Ŀո��ڡ�
���� | �����Լ� | �����Լ� |
(��)����(��ϩ) | ________�� | ________�� |
(��)�ƾ�(ˮ) | ________�� | ________�� |
�ټ����Լ���
A����ˮ����ͭ B�����Ը��������Һ
C��ˮ D������������Һ
�ڳ����Լ���
a����ˮ����ͭ b������
c�����Ƶ���ʯ�� d����ˮ
����ʱ����ϩ������Ӧ�Ļ�ѧ����ʽΪ____________________��
(2)��ͼ�������Թ����ȼ���2 mL 95%���Ҵ�������ҡ���»�������3 mLŨ���ᣬ�ټ���2 mL���ᣬ���ҡ�ȡ���ͼ���Ӻ�װ�ã��þƾ��ƶ����Թ�С�����3��5 min���ô����ȣ����۲쵽���Թ�������������ʱֹͣʵ�顣
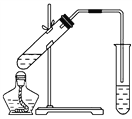
�Իش�
�����Թ���ͨ������________��Һ��ʵ�����ɵ��������������ܶȱ�ˮ________������������ζ��Һ�塣�������Թ����������������IJ���Ϊ(ֻ������)________����Ӧ�м���Ũ�����������_____________________________________________________��