题目内容
水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的冰,其结构如图2-13所示:
图2-13
(1)含1 mol冰中有___________mol“氢键”。
(2)水分子中可电离生成两种含有相同电子数的微粒,其电离方程式为___________。
(3)在冰的结构中,每个水分子与相邻的4个分子氢键相连接。在冰中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰中氢键的能量是__________kJ·mol-1。
(4)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系______________________,其判断依据是______________________。
解析:H2O中1个O有两对孤对电子,可以与另外2个H2O中的H原子产生电性作用,从而形成2个氢键,H2O电离后形成的2个离子是H3O+和OH-,氢键的键能为![]() =20.00 kJ·mol-1。
=20.00 kJ·mol-1。
答案:(1)2 (2)2H2O![]() H3O++OH- (3)20.00 (4)x>z>y H2O中存在氢键,H2Se的相对分子质量大于H2S的,故H2Se的分子间作用力大于H2S
H3O++OH- (3)20.00 (4)x>z>y H2O中存在氢键,H2Se的相对分子质量大于H2S的,故H2Se的分子间作用力大于H2S

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目

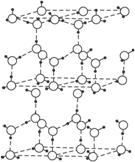

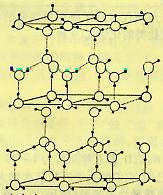 水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体一次,其结构示意图如图所示
水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体一次,其结构示意图如图所示