题目内容
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO+Cr2O3(s)+8Na2CO3(s)+7O2 ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2 ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2 ΔH<0
(1) 请写出上述反应的化学平衡常数表达式:K=__________________。
(2) 图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。
由图1判断,反应进行至t2时,曲线发生变化的原因是____________________(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加了催化剂 c.通入O2 d.缩小容器体积

(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ,
CH3OH(g)+H2O(g) ,
① 已知该反应能自发进行,则下列图像正确的是______________________

②在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考查温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)

A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率:v(CH3OH)= ![]() mol·L-1·min-1
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为放热反应
D.处于A点的反应体系从T1变到T2,达到平衡时 ![]() 增大
增大
③ 在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,CO2转化率为a,则容器内的压强与起始压强之比为___________。
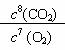 (1)
(1)
(2) 对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小,b
(3) ① A C ② C D ③ 1-0.5a

 一诺书业暑假作业快乐假期云南美术出版社系列答案
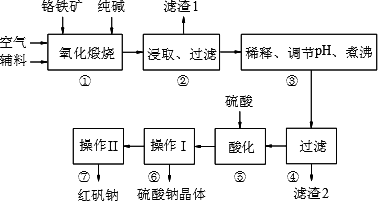
一诺书业暑假作业快乐假期云南美术出版社系列答案(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。

①步骤Ⅰ中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2
8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________。
A.升高温度 B.将原料粉碎
C.增加纯碱的用量 D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是________________________。
③步骤Ⅲ需将溶液的pH调至7—8并煮沸,其目的是_______________________________。
④步骤Ⅳ中发生反应的离子方程式为__________________。
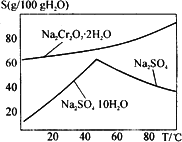
(2)将红矾钠与KCl固体按1∶2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。
序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解 |
② |
|
|
③ |
|
|
④ |
|
|
⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO?Cr2O3、还含有Al2O3、SiO2)。某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7)。实验流程为:
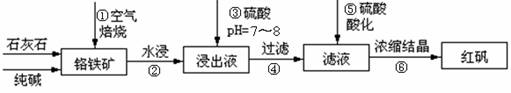
已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO?Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在_______(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器____。
(2)步骤③用硫酸将溶液的pH调至7~8,目的是 ;
并写出有关的离子方程式 。
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为 。
(4)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。②③④的实验操作方法分别是_______________。
| 序号 | 实验操作方法 | 实验操作过程 |
| ① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌 |
| ② | 将所得溶液沿玻璃棒引流至蒸发皿中,边加热边用玻璃棒搅拌溶液,使NaC1结晶析出 | |
| ③ | 趁热将NaC1晶体与溶液分离 | |
| ④ | 冷却滤液使K2Cr2O7析出 | |
| ⑤ | 过滤 | 得到K2Cr2O7晶体 |