题目内容
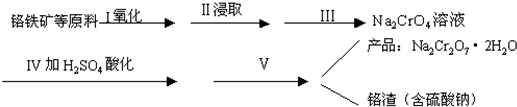
红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:①铬铁矿(可视为FeO?Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)
②焙烧产物加水后,并用硫酸调成中性溶液
③过滤、滤液加硫酸酸化、浓缩、结晶成红矾
(1)完成下列化学方程式:
SiO2+CaCO3![]() ;
;
Al2O3+Na2CO3![]() 。
。
(2)配平下列反应方程式,填上系数:
FeO?Cr2O3+ Na2CO3+ O2 ¾ Na2CrO4+ Fe2O3+ CO2 (3)用水浸取焙烧产物,并用硫酸调成中性的目的是
并写出有关的离子方程式
(1)SiO2+CaCO3![]() CaSiO3+CO2↑;
CaSiO3+CO2↑;
Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(2)4FeO?Cr2O3+8Na2CO3+7O2 == 8Na2CrO4+2Fe2O3+8CO2
(3)提取可溶物质,并使AlO2-转化成Al(OH)3
有关的离子方程式是: AlO2-+H++H2O == Al(OH)3 ¯

 名校课堂系列答案
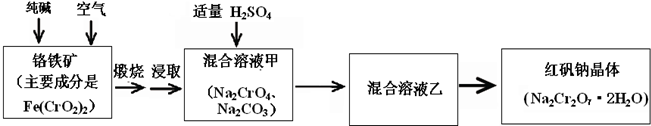
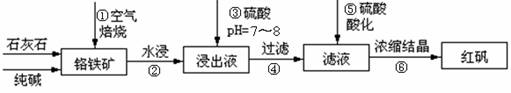
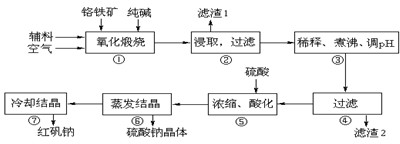
名校课堂系列答案工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO?Cr2O3、还含有Al2O3、SiO2)。某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7)。实验流程为:
已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO?Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在_______(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器____。
(2)步骤③用硫酸将溶液的pH调至7~8,目的是 ;
并写出有关的离子方程式 。
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为 。
(4)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。②③④的实验操作方法分别是_______________。
| 序号 | 实验操作方法 | 实验操作过程 |
| ① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌 |
| ② | 将所得溶液沿玻璃棒引流至蒸发皿中,边加热边用玻璃棒搅拌溶液,使NaC1结晶析出 | |
| ③ | 趁热将NaC1晶体与溶液分离 | |
| ④ | 冷却滤液使K2Cr2O7析出 | |
| ⑤ | 过滤 | 得到K2Cr2O7晶体 |
 Cr2O72-+H2O
Cr2O72-+H2O