题目内容
【题目】反应mA(s)+nB(g) ![]() eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是

A. 到平衡后,加入催化剂则C%增大
B. 化学方程式中n<e+f
C. 达到平衡后,若升温,平衡左移
D. 达到平衡后,增加A的量有利于平衡向右移动
【答案】C
【解析】
A.加入催化剂使正反应速率和逆反应速率同等程度的增大,平衡没有移动,所以C的含量没有改变,A项错误;
B.从图像上可以看出,温度一定时C的含量随压强的增大而增大,即增大压强平衡向正反应方向移动,根据勒夏特列原理,正反应方向气体体积减小,即n>e+f,B项错误;
C.由图像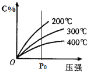 可知,当压强一定(如P0)时,温度升高(2000C→3000C→4000C)生成物C的含量减小,平衡向逆反应方向(即向左)移动,C项正确;
可知,当压强一定(如P0)时,温度升高(2000C→3000C→4000C)生成物C的含量减小,平衡向逆反应方向(即向左)移动,C项正确;
D.A是固体,固体浓度视为常数,增加A的量平衡不发生移动,D项错误;答案选C。

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目







