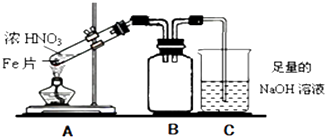
��Ŀ����
����Ŀ��A��B��C��D��E��XΪ��ѧ�������ʣ����ǵ�ת����ϵ��ͼ��ʾ����Ӧ����δע�����������������Ϣ�ش����⣮ 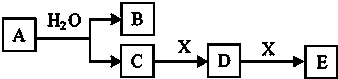
��1����AΪ���ʣ�EΪ��ɫ�������Ҽ�������������������C��Һ����
��D��X������Ӧ�����ӷ���ʽΪ��
�ڳ�����pH=10��C��Һ��D��Һ�У�ˮ�ĵ���̶�����C��D����
��2����AΪ���ӻ����BΪ�����ڼ�İ�ɫ�����E��ˮ��Ӧ���ɵ�Ũ��ҺG��C�а��̲�������
��A�Ļ�ѧʽΪ��
�ڵ����ʵ���Ũ�ȵ�G��Һ��C��Һ�������ϣ����Һ�е������غ�ʽΪ�� �� ������Ũ�ȱ�ʾ��
���𰸡�
��1��3AlO2��+Al3++6H2O=4Al��OH��3����D
��2��Mg3N2��c��H+��=c��OH����+c��NH3?H2O��
���������⣺��1.����AΪ���ʣ�EΪ��ɫ�������Ҽ�������������������C��Һ���������и����ת����ϵ��C��������X��Ӧ������֪��AΪ�ƣ�BΪ������CΪ�������ƣ�XΪ�Ȼ�����DΪƫ�����ƣ�EΪ������������D��X������Ӧ�����ӷ���ʽΪ3AlO2��+Al3++6H2O=4Al��OH��3�������Դ��ǣ�3AlO2��+Al3++6H2O=4Al��OH��3��������������������Һ��ǿ���ˮ�ĵ������������ã���ƫ��������ӷ���ˮ�⣬��ˮ�ĵ�����ٽ����ã����Գ�����pH=10������������Һ��ƫ��������Һ�У�ˮ�ĵ���̶�NaAlO2��
���Դ��ǣ�D��
��2.����AΪ���ӻ����E��ˮ��Ӧ���ɵ�Ũ��ҺG��C�а��̲�������CΪ������E����C��X������Ӧ�õ��ģ�����EΪNO2 �� GΪ������Һ������XΪ���������BΪ�����ڼ�İ�ɫ�������C��֪AΪMg3N2 �� BΪMg��OH��2 �� �ٸ�������ķ�����֪��A�Ļ�ѧʽΪMg3N2 �� ���Դ��ǣ�Mg3N2���ڵ����ʵ���Ũ�ȵ�G��Һ��C��Һ�������ϣ��õ�NH4NO3��Һ��笠�����ˮ�⣬������NH4NO3��Һ�е������غ�ʽΪc��H+��=c��OH����+c��NH3H2O�������Դ��ǣ�c��H+��=c��OH����+c��NH3H2O����

 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�����Ŀ��N��O��Na��Mg��S��Br�dz���������Ԫ�أ�
��1��Brλ��Ԫ�����ڱ������ڵ��壻Na��O�γ�1��1�Ļ�����ĵ���ʽ�� �� �����ʺ��еĻ�ѧ��Ϊ�� ��
��2���á�����������գ�
�ȶ��� | ���Ӱ뾶 | �۵� | ���ļ��� |
NH3H2O | O2��Mg2+ | SO3 | H��O |
��3����֪������һ�崢�ܵ����һ�ֶ��ε�أ��ṹ��ͼ������ܷ�ӦΪ��2Na2S3+2NaBr ![]() 3Na2S2+Br2�ٷŵ�ʱNa+����Ǩ�ƣ��a��b��������
3Na2S2+Br2�ٷŵ�ʱNa+����Ǩ�ƣ��a��b��������
�ڷŵ�ʱ�����ĵ缫��ӦʽΪ��
��4����֪N4Ϊ��������ṹ��N��N����Ϊ167kJmol��1 �� N��N����Ϊ942kJmol��1 �� д��N4��g��ת��ΪN2��g�����Ȼ�ѧ����ʽ ��