题目内容
【题目】常温下,用0.1molL﹣1 NaOH溶液滴定20mL 0.1molL﹣1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )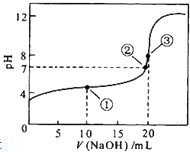
A.点①所示溶液中:c(Na+)>c(CH3COO﹣)>c(CH3COOH)>c(H+)>c(OH﹣)
B.点②所示溶液中:c(Na+)+c(H+)=c(CH3COO﹣)+c(CH3COOH)+c(OH﹣)
C.点③所示溶液中:c(CH3COO﹣)>c(Na+)>c(OH﹣)>c(H+)
D.在整个滴定过程中:溶液中 ![]() 始终不变
始终不变
【答案】D
【解析】解答:A.点①所示溶液中,滴入10mL氢氧化钠溶液,则反应后溶液中溶质为等浓度的醋酸钠和醋酸,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则:c(H+)>c(OH﹣)、c(CH3COO﹣)>c(CH3COOH),结合物料守恒可得:c(CH3COO﹣)>c(Na+)>c(CH3COOH),所以A错误;
B.点②所示溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),则c(Na+)+c(H+)<c(CH3COO﹣)+c(CH3COOH)+c(OH﹣),所以B错误;
C.点③所示溶液中,氢氧化钠与醋酸恰好反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性,则:c(CH3COO﹣)<c(Na+)、c(OH﹣)>c(H+),溶液中离子浓度大小为:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),所以C错误;
D. ![]() 为醋酸电离平衡常数的倒数,由于滴定过程中醋酸的电离平衡常数始终不变,则
为醋酸电离平衡常数的倒数,由于滴定过程中醋酸的电离平衡常数始终不变,则 ![]() 的值不变,所以D正确;所以选D.
的值不变,所以D正确;所以选D.
分析:本题考查了离子浓度大小比较、酸碱混合的定性判断,明确反应后溶液中的溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.