题目内容
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E.蒸发结晶 F.高温分解 |
②除去澄清石灰水中悬浮的CaCO3: ;
③除去CaO固体中少量的CaCO3固体: ;
④从碘水中提取碘: ;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物: 。
①A ②B ③F ④C ⑤D
解析试题分析:① CCl4和H2O互不相溶,会分层,所以用分液法;② CaCO3不溶于水,过滤可除;③加热CaCO3固体高温分解得到CaO和二氧化碳;④碘难溶于水易溶于有机溶剂,萃取法;⑤CCl4和甲苯的沸点相差较大,蒸馏法分离。
考点:考查除杂、物质的分离和提纯。

 名校课堂系列答案
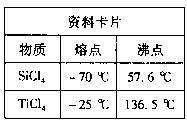
名校课堂系列答案铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: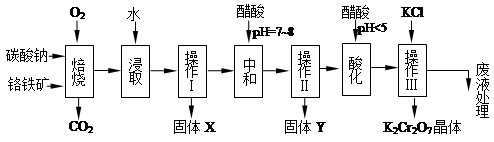
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
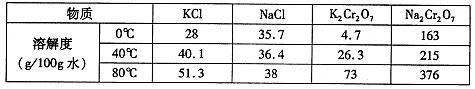
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_______(用含m、n的代数式表示)。
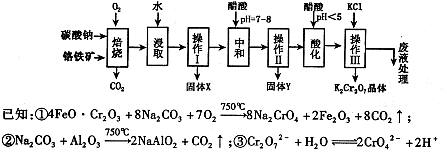
(6)六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:

CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿(主要成份:CuO ZnO)的方案,实现废物综合利用,方案如下图所示。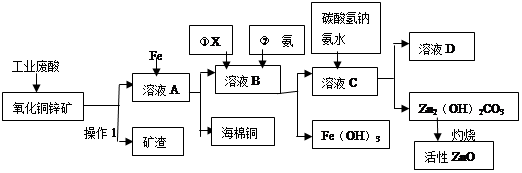
请回答下列问题:
(1)操作1的名称是:
(2)向溶液A中加入Fe粉发生的主要的反应离子方程式为: 、 。
(3)向溶液B中加入物质X的目的是 ,物质X可用下列物质中的 。(填字母)
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
(5)溶液D中主要溶质的化学式是 。
(6)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(Ⅰ)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: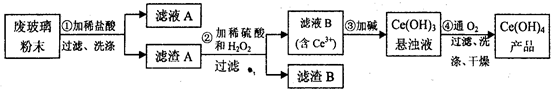
(1)洗涤的目的主要是为了除去Cl-和___________(填离子符号),检验该滤渣A洗净的方法是_____________________。
(2)第②步反应的离子方程式是____________________________。
(3)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000mol· L-1FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为_____________。
(Ⅱ)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: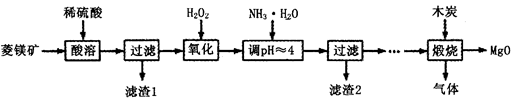
(1)加入H2O2氧化时,发生反应的化学方程式为________________。
(2)滤渣2的成分是______________(填化学式)。
(3)煅烧过程存在以下反应:2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。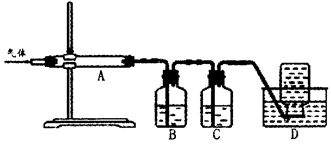
①D中收集的气体可以是______________(填化学式)。
②B中盛放的溶液可以是______________(填字母)。
| A.NaOH溶液 | B.Ca(OH)2溶液 | C.稀硝酸 | D.KMnO4溶液 |
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下: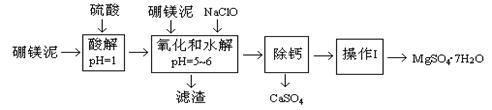
已知:NaClO与Mn2+反应产生MnO2沉淀。
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 、 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 、 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是 。
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为 (相对分子质量:MgSO4·7H2O-246 MgO-40)。

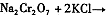
 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。