题目内容
【题目】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6mol·L-1硫酸溶液中,乙同学将电极放入6mol·L-1的氢氧化钠溶液中,如图所示。
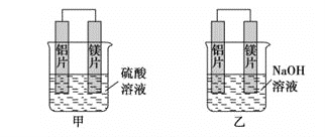
(1)写出甲池中正极的电极反应式__。
(2)写出乙池中负极的电极反应式__。
(3)写出乙池中总反应的离子方程式__。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__活动性更强,而乙会判断出__活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确(________)
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法__(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案__(如可靠,此空可不填)。
【答案】2H++2e-=H2↑ 2Al+8OH--6e-=2AlO2-+4H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ Mg Al AD 不可靠 将两种金属作电极连上电流计后插入电解质溶液,构成原电池,利用电流计测定电流的方向,从而判断电子流动方向,再确定原电池正负极
【解析】
甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑。由于铝与碱的反应是一个特例,不可作为判断金属性强弱的依据。判断原电池的正极、负极要依据实验事实。
(1)甲中镁与硫酸优先反应,甲池中正极上氢离子得电子产生氢气,电极反应式为:2H++2e-=H2↑;
(2)乙池中负极上铝失电子在碱性条件下生成AlO2-,电极反应式为2Al+8OH--6e-=2AlO2-+4H2O;
(3)乙池中铝与氢氧化钠反应,镁与氢氧化钠不反应,总反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(5)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故A正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故B错误;、
C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,故C错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故D正确;
故选AD;
(6)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法不可靠。可行实验方案如:将两种金属作电极连上电流计后插入电解质溶液,构成原电池,利用电流计测定电流的方向,从而判断电子流动方向,再确定原电池正负极。

 名校课堂系列答案
名校课堂系列答案