题目内容
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(1)+O2(g)=N2(g)+2H2O(g) △H1=-621.5kJmol-1
②N2O4(1)=N2(g)+2O2(g) △H2=+204.3kJmol-1
则火箭燃料的燃烧反应为2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H=__。
(2)已知反应N2H4(g)+2Cl2(g)![]() N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
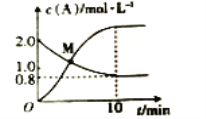
①0~10min内,用N2(g)表示的平均反应速率v(N2)=__。
②M点时,N2H4的转化率为__(精确到0.1)%。
③T℃时,达到平衡后再向该容器中加入1.2molN2H4(g)、0.4molCl2(g)、0.8molN2(g)、1.2molHCl(g),此时平衡__(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下,1.0molL-1的NaH2PO2溶液pH为8,则次磷酸的Ka=__。
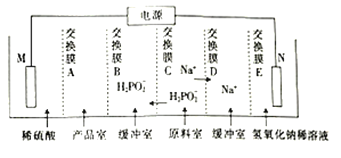
②用次磷酸钠通过电渗析法制备次磷酸,装置如图所示。交换膜A属于__(“阳离子”或“阴离子”)交换膜,电极N的电极反应式为___。
【答案】-1038.7kJ·mol-1 0.06mol·L-1·min-1 33.3 逆向移动 1.0×10-2 阳离子 2H2O+2e- =H2↑+2OH-(或2H++2e- =H2↑)
【解析】
(1)已知:①N2H4(1)+O2(g)=N2(g)+2H2O(g) △H1=-621.5kJmol-1
②N2O4(1)=N2(g)+2O2(g) △H2=+204.3kJmol-1
利用盖斯定律,①×2+②,即得2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1。答案为:-1038.7kJ·mol-1;
(2)①0~10min内,消耗氯气浓度c(Cl2)=1.2mol/L,则c(N2)=0.6mol/L,v(N2)=![]() =0.06mol·L-1·min-1。答案为:0.06mol·L-1·min-1;
=0.06mol·L-1·min-1。答案为:0.06mol·L-1·min-1;
②M点时,设参加反应的N2H4的物质的量为x,则三段式为:
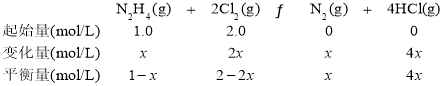
则2-2x=4x,x=![]() mol/L,N2H4的转化率为
mol/L,N2H4的转化率为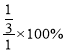 =33.3%。答案为:33.3;
=33.3%。答案为:33.3;
③从图中可看出,平衡时c(Cl2)=0.8mol/L,则由三段式可得:

K=![]() =77.76,Q=
=77.76,Q=![]() =81>77.76,平衡逆向移动。答案为:逆向移动;
=81>77.76,平衡逆向移动。答案为:逆向移动;
(3)①常温下,1.0molL-1的NaH2PO2溶液pH为8,水解常数Kh=![]() ,Ka=
,Ka=![]() =
=![]() =1.0×10-2。答案为:1.0×10-2;
=1.0×10-2。答案为:1.0×10-2;
②先分析装置图,从而确定产品室应生成次磷酸,则H2PO2-应从缓冲室进行入产品室,从而得出交换膜B为阴离子交膜,交换膜A应允许H+进入产品室,以便与H2PO2-结合生成H3PO2,所以M电极应生成H+,此电极H2O电离出的OH-失电子,为阳极。C为阴离子交换膜,D为阳离子交换膜,N为阴极,H2O电离出的H+得电子,缓冲室中的Na+透过离子交换膜E进入氢氧化钠稀溶液中,从而得出交换E为阳离子交换膜。N电极为阴极,H2O电离出的H+得电子,电极反应为2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑)。