题目内容
【题目】下列说法不正确的是
A.光导纤维的主要成分是晶体硅
B.镁可用于制造信号弹和焰火
C.氢氧化铁胶体能用于净水
D.二氧化碳不可用于漂白纸浆
【答案】A
【解析】
A. 光导纤维的主要材料是二氧化硅,不是晶体硅,A错误;
B. 镁在空气中点燃,剧烈燃烧,发出耀眼的白光,放出大量的热,生成氧化镁白色固体,镁是制造信号弹和焰火的原料,B正确;
C. 氢氧化铁胶体具有较大的表面积,吸附能力强,能吸附水中悬浮的杂质,达到净水的目的,C正确;
D. 二氧化硫具有漂白性,可用于漂白纸浆,二氧化碳没有漂白性,不可用于漂白纸浆,D正确;
故选A。

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐不是加碘盐 |
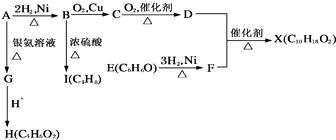
B | 银氨溶液中滴入少量组成为C2H4O2的液态有机物,水浴微热,有银镜出现 | 可确定该有机物一定是甲酸甲酯 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3-=I2+I- |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性高锰酸钾溶液,溶液紫色褪去 | 制得的气体产物为乙烯 |
A. A B. B C. C D. D
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
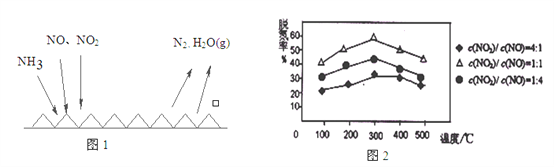
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
【题目】H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1molL﹣1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式: .
②设计实验方案:在不同H2O2浓度下,测定(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 | 0.1molL﹣1Fe2(SO4)3 | 30% H2O2 | H2O |
1 | 0.5 | 15 | |
2 | 0.5 | 30 | 9.5 |
④查阅资料,30%的H2O2的密度为1.13g/mL,若实验测得实验2中H2O2全部分解所需的时间为2min,则用H2O2表示该反应在2min内的平均速率为(设溶液体积变化忽略不计)
(2)利用图2﹣(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是