题目内容
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0
(1)图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程![]() 曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
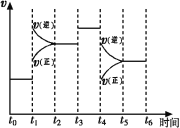
t4时改变的条件是________________。
现进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)反应在0—10分钟内以氮气浓度变化表示的反应速率为___________,该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L/span>,则此时V正_____V逆 (填“>”“<”或“=”)。
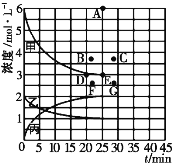
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______(填“甲”“乙”或“丙”)。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
【答案】D 减小压强或增大容积体积 0.08mol/(L·min) ![]() (或0. 148或0. 15均可) > 乙 B
(或0. 148或0. 15均可) > 乙 B
【解析】
(1)从化学平衡移动的角度进行分析;
(2)根据化学速率的表达式进行计算;利用三段式计算化学平衡;
(3)利用Qc与K之间的关系进行分析;
(4)利用影响化学速率的因素以及影响化学平衡移动的因素进行分析。
(1)根据图像,t1-t2时间反应向逆反应方向进行,消耗NH3,t3-t4时间段,化学平衡不移动,t4-t5时间段,反应向逆反应方向进行,消耗NH3,因此氨气的体积分数最小的时间段是t5-t6,故选项D正确;t4时刻,正逆反应速率都降低,可能降低温度,也可能减小压强,如果是降低温度,该反应为放热反应,平衡影响正反应方向进行,v正>v逆,不符合图像,因此只能是减小压强,
故答案为D;减小压强或增大容器的体积;
(2)0-10min消耗H2的物质的量为(6.00-3.60)mol=2.40mol,根据反应方程式,消耗N2的物质的量为![]() =0.8mol,依据反应速率的数学表达式,v(N2)=
=0.8mol,依据反应速率的数学表达式,v(N2)=  =0.08mol/(L·min);
=0.08mol/(L·min); 容器的体积为1L,则N2、H2、NH3的平衡浓度分别是1mol·L-1、3mol·L-1、2mol·L-1,根据化学平衡常数的表达式,K=
容器的体积为1L,则N2、H2、NH3的平衡浓度分别是1mol·L-1、3mol·L-1、2mol·L-1,根据化学平衡常数的表达式,K=![]() ,
,
故答案为0.08mol/(L·min);![]() (或0. 148或0. 15均可);
(或0. 148或0. 15均可);
(3)利用Qc=![]() <
<![]() 平衡向正反应方向进行,即v(正)>v(逆),
平衡向正反应方向进行,即v(正)>v(逆),
故答案为>;
(4)开始通入N2、H2物质的量浓度分别是2mol·L-1、6mol·L-1,根据图像,起点为2mol·L-1的点为乙曲线,则乙曲线表示c(N2)-t的曲线;根据上述分析,曲线甲表示c(H2)-t,在此温度下,起始充入4molN2和12molH2,相当于在原来基础上增大压强,化学反应速率加快,达到平衡所用时间缩短,相当于在原来基础上增大压强,该反应的平衡向正反应方向进行,即比原平衡的2倍小,则应是B点,
故答案为乙;B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。

请回答下列问题:
(1)步骤I中除了2Li + 2H2O=2 Li OH + H2↑反应外,主要发生的化学反应方程式为____________________。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |