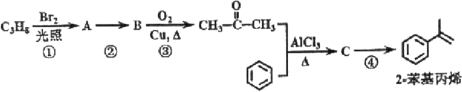
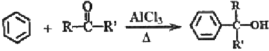题目内容
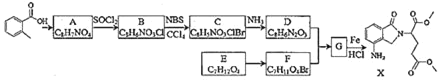
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
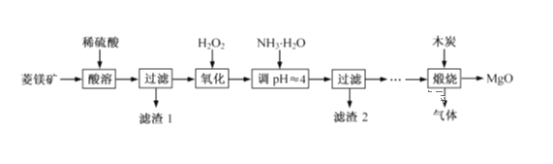
(1)MgCO3与稀硫酸反应的离子方程式为__________________________。
(2)加入H2O2氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式),过滤分离需要的玻璃仪器有 __________________。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用图装置对煅烧产生的气体进行分步吸收或收集。
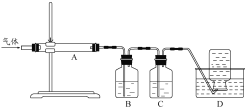
D中通过排水法收集的气体可以是___________(填化学式)。C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
(5)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
【答案】MgCO3+2H+=Mg2++H2O+CO2↑ H2O2+2Fe2++2H+=2Fe3++2H2O Fe(OH)3 烧杯,漏斗,玻璃棒 CO c d 3S+6OH-=2S2-+SO32-+3H2O
【解析】
菱锰矿中加入稀硫酸,发生的反应为MgCO3+H2SO4=MgSO4+CO2↑+H2O、FeCO3+H2SO4=FeSO4+H2O+CO2↑,然后过滤得到滤渣1和溶液,向溶液中加入双氧水,亚铁离子被氧化生成铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入氨水,并调节溶液的pH为4左右,发生的离子反应为Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+,铁离子转化为沉淀,然后过滤得到滤渣2为Fe(OH)3,经过一系列操作最后和木炭煅烧得到MgO和气体,根据此分析解答。
(1)MgCO3与稀硫酸反应生成硫酸镁和二氧化碳、水,离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O;
(2)双氧水具有氧化性,亚铁离子具有还原性,所以双氧水能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)通过以上分析知,滤渣2的成分是Fe(OH)3;过滤时用到的玻璃仪器为烧杯,漏斗,玻璃棒。
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液(或硝酸)吸收二氧化硫和硫蒸气,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;则D中收集的气体可以是CO;B中盛放的溶液用于吸收二氧化硫和硫蒸气转化为非气态物质,可用强氧化性的溶液吸收,故答案选cd;
(5)A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0
(1)图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程![]() 曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
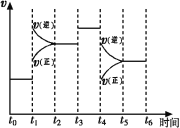
t4时改变的条件是________________。
现进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)反应在0—10分钟内以氮气浓度变化表示的反应速率为___________,该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L/span>,则此时V正_____V逆 (填“>”“<”或“=”)。
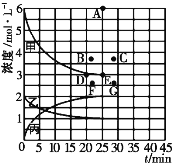
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______(填“甲”“乙”或“丙”)。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。