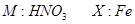题目内容
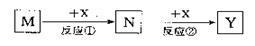
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
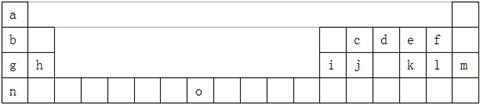
试回答下列问题:
(1)请写出:元素o的基态原子电子排布式_________
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为_______。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有___个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为________(填元素符号)
(5) 所有元素 其中电负性最大的是___(填图中的序号或元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为__________;(填化学式)

试回答下列问题:
(1)请写出:元素o的基态原子电子排布式_________
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为_______。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有___个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为________(填元素符号)
(5) 所有元素 其中电负性最大的是___(填图中的序号或元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为__________;(填化学式)
(13分)(1)1s22s22p63s23p63d64s2
(2)V形或三角形或平面三角形, sp2,极性。
(3)四面体形。4
(4)Mg>Al>Na
(5) f或F; H2SO4>H2SO3 (前五空各1分,后四空各2分)
(2)V形或三角形或平面三角形, sp2,极性。
(3)四面体形。4
(4)Mg>Al>Na
(5) f或F; H2SO4>H2SO3 (前五空各1分,后四空各2分)
试题分析:(1)同一周期自左而右,第一电离能呈增大的趋势,同主族自上而下,第一电离能逐渐降低,故第一电离能最小的应在周期表的左下方,第一电离能最大的元素应在周期表的右上方,但稀有气体的第一电离能最大;
由元素在周期表中的位置可知,c、d、e三种元素分别为C、N、O元素,N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素;a为H元素,三者与a形成的化合物为氢化物,同周期自左而右,非金属性增强,非金属性越强,氢化物越稳定.
(2)同周期自左而右,电负性增大,故第三周期中电负性最大的元素是Cl,电负性最小的元素是Na.
(3)表中基态原子可以形成+2离子,属于金属,未成对电子数最多,故为过渡元素中的o(Fe),根据核外电子排布规律书写Fe2+的外围电子排布式.
(4)由元素在周期表中的位置可知,a为H元素、d为N元素、e为O元素,三种元素组成的一种离子化合物为硝酸铵,铵根离子水解使溶液呈酸性。
点评:考查元素周期表的结构、元素周期律、核外电子排布规律、盐类水解等,难度中等,注意基础知识的掌握。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目