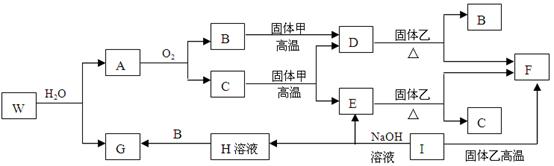
题目内容
A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D。D和A形成简单离子后,它们电子层相差两层。已知A处于第n族,D处第m族,且A单质中只含共价健。B的气态氢化物的分子式为H2B,在其最高氧化物中B的质量分数为40%,B原子核内质子数和中子数相等。C与A可形成CA3型化合物,C与A、B在同一周期,B与A左右相邻。试回答:
(1).若n-m=6,则A与D形成化合物电子式为 ;
(2).D的原子序数为 ;(用含m代数式表示)
(3).A和B的简单离子半径大小关系 ;(用离子符号表示)
(4).向A、C形成的化合物中滴入氨水,其反应的离子方程式为 。
(1).若n-m=6,则A与D形成化合物电子式为 ;
(2).D的原子序数为 ;(用含m代数式表示)
(3).A和B的简单离子半径大小关系 ;(用离子符号表示)
(4).向A、C形成的化合物中滴入氨水,其反应的离子方程式为 。
(12分,每小题3分)(1)氯化锂电子式 (2) m + 2 (3)S2->Cl- (4) Al3+ +3NH3H2O = Al(OH)3↓ + 3NH4+
试题分析:B的气态氢化物的分子式为H2B,则B是第ⅥA族元素,最高价是+6价,即最高价氧化物是BO3。设B的质子数是x,则
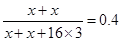 ,解得x=16,所以B是S元素。A单质中只含共价健,且A的原子序数对于16,所以A是氯元素。D和A形成简单离子后,它们电子层相差两层,而n-m=6,所以m=1,则D是Li元素。。C与A可形成CA3型化合物,C与A、B在同一周期,B与A左右相邻,且C的原子序数小于B的,所以C应该是Al元素。
,解得x=16,所以B是S元素。A单质中只含共价健,且A的原子序数对于16,所以A是氯元素。D和A形成简单离子后,它们电子层相差两层,而n-m=6,所以m=1,则D是Li元素。。C与A可形成CA3型化合物,C与A、B在同一周期,B与A左右相邻,且C的原子序数小于B的,所以C应该是Al元素。(1)若n-m=6,则A与D形成化合物是LiCl,属于离子化合物,电子式为
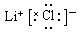 。
。(2)D位于第二周期第m族,所以原子序数是m+2。
(3)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以离子半径是S2->Cl-。
(4)氯化铝能和氨水反应生成氢氧化铝白色沉淀,反应的离子方程式是Al3+ +3NH3H2O =Al(OH)3↓+ 3NH4+
。
点评:该题是中等难度的试题,试题基础性强,注重能力的培养,侧重对基础知识的巩固与检验,有利于培养学生的逻辑思维能力和发散思维能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目