��Ŀ����
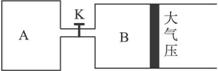
��ͼ1��A��B��������ֱ��ռ������ֻ������õ��������塣�����м��������ͼ2��ʾ����������������������ֲ������������С�����һ�������������仯���Է����̡����ڴ˹��̵�����˵���в���ȷ���� ��?( )?A.�˹���Ϊ���ҳ̶�С������ҳ̶ȴ�ķ���ı仯���̣���������Ĺ���?
B.�˹���Ϊ�Է����̣�����û�����������ջ�ų�?
C.�˹��̴����������Ҷ�����?
D.�˹������Է������?
ͼ1?

ͼ2������������Է����
������������֪��H=0����S��0���ɦ�H-T��S֪�ù��̵�����̲����Է����У�����D����
�𰸣�D

��ϰ��ϵ�д�
�����Ŀ

 ��2009?����ģ�⣩�״�������ˮ������Ӧ������������Ӧ����ʽ���£�
��2009?����ģ�⣩�״�������ˮ������Ӧ������������Ӧ����ʽ���£�