��Ŀ����
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H2��g��?CH3OH��g����H��0��
��1��������Ӧ��ƽ�ⳣ������ʽΪK=
�������й�˵����ȷ����
a�����¡����������£������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ��
b��һ�������£�H2������������CO���������ʵ�2��ʱ���淴Ӧ�ﵽƽ��
c����������������䣬�����¶ȿ����CO��ת����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
��2������������ͬʱ����T1��T2��T1��T2��������ͬ�¶��¿��淴Ӧ�ﵽƽ�⣬����ͼ1�л���CO��ת������ʱ��仯��ʾ��ͼ��

��3����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-a kJ?mol-1
��2CO��g��+O2��g��=2CO2��g����H=-b kJ?mol-1
��H2O��g��=H2O��l����H=-c kJ?mol-1
�� CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=
��4��2009��10�£��й���ѧԺ����Ӧ�û�ѧ�о����ڼ״�ȼ�ϵ�ؼ�����������ͻ�ƣ���װ�����Ժ�����ؼ�����ʽ��ѣ��״�ȼ�ϵ�صĹ���ԭ����ͼ2��ʾ��
C�������ĵ缫��ӦʽΪ��
��H��1 C��12 O��16��
��1��������Ӧ��ƽ�ⳣ������ʽΪK=
| [CH3OH] |
| [CO][H2]2 |
| [CH3OH] |
| [CO][H2]2 |
a
a
a�����¡����������£������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ��
b��һ�������£�H2������������CO���������ʵ�2��ʱ���淴Ӧ�ﵽƽ��
c����������������䣬�����¶ȿ����CO��ת����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
��2������������ͬʱ����T1��T2��T1��T2��������ͬ�¶��¿��淴Ӧ�ﵽƽ�⣬����ͼ1�л���CO��ת������ʱ��仯��ʾ��ͼ��

��3����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-a kJ?mol-1
��2CO��g��+O2��g��=2CO2��g����H=-b kJ?mol-1
��H2O��g��=H2O��l����H=-c kJ?mol-1
�� CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=
��H=
| b-a-4c |
| 2 |
��H=
kJ?mol-1��| b-a-4c |
| 2 |
��4��2009��10�£��й���ѧԺ����Ӧ�û�ѧ�о����ڼ״�ȼ�ϵ�ؼ�����������ͻ�ƣ���װ�����Ժ�����ؼ�����ʽ��ѣ��״�ȼ�ϵ�صĹ���ԭ����ͼ2��ʾ��
C�������ĵ缫��ӦʽΪ��
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
������һ��ʱ���6.4g�״���ȫ��Ӧ����CO2ʱ����1.2
1.2
NA�����ӷ���ת�ƣ���H��1 C��12 O��16��
��������1������ƽ�ⳣ������ʽK=
����д�����ݻ�ѧƽ��״̬�������ͱ�־���ж�ij��״̬�Ƿ���ƽ��״̬��
��2�����ڷ��ȷ�Ӧ���¶����ߣ���Ӧ���ʼӿ죬ƽ���������ȷ�����У�
��3�����ݸ�˹���������㻯ѧ��Ӧ���ʱ䣻
��4����ȼ�ϵ���У�������ȼ�Ϸ���ʧ���ӵ�������Ӧ�����������������õ��ӵĻ�ԭ��Ӧ��
| ����������ƽ��Ũ��ϵ���η��ij˻� |
| ������Ӧ��ƽ��Ũ��ϵ���η��ij˻� |
��2�����ڷ��ȷ�Ӧ���¶����ߣ���Ӧ���ʼӿ죬ƽ���������ȷ�����У�
��3�����ݸ�˹���������㻯ѧ��Ӧ���ʱ䣻
��4����ȼ�ϵ���У�������ȼ�Ϸ���ʧ���ӵ�������Ӧ�����������������õ��ӵĻ�ԭ��Ӧ��
����⣺��1����Ӧ�Ļ�ѧƽ�ⳣ��K=
��
a�����¡����������£����ڷ�Ӧǰ����������仯�ķ�Ӧ���������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ�⣬��a��ȷ��b��һ�������£�H2������������CO���������ʵ�2��ʱ������Եó���Ӧֻ������������У������������淴Ӧ������ȣ���b����
c����������������䣬�����¶ȣ�ƽ������������У��ɽ���CO��ת���ʣ���c����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲻�����CH3OH�IJ����ͷ�Ӧ���ת���ʣ���d����
�ʴ�Ϊ��
��a��
��2�������¶ȣ�ƽ������������У��ɽ���CO��ת���ʣ������¶����ߣ���ѧ��Ӧ���ʼӿ죬�ﵽ��ѧƽ��״̬����ʱ��̣���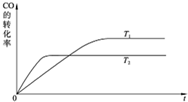 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3�����ݸ�˹���ɣ���ӦCH3OH��l��+O2��g��=CO��g��+2H2O��l���뷴Ӧ��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-a kJ?mol-1��2CO��g��+O2��g��=2CO2��g����H=-b kJ?mol-1��H2O��g��=H2O��l����H=-c kJ?mol-1
��
����-��+�ۡ�4���ɵ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Է�Ӧ���ʱ��H=
kJ?mol-1��
�ʴ�Ϊ��
��
��4������װ�ÿ���֪��d�����ɴ�����ˮ������e�缫��ͨ��������������缫��ӦΪ��O2+4e-+4H+=2H2O����6.4g�״���ȫ��Ӧ����CO2ʱ�����ݷ�Ӧ2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g���������ļ״�2molʱ��ת�Ƶ���Ϊ12mol�����Ե�6.4g�״���0.2mol�״���ȫ��Ӧ����CO2ʱ��ת�Ƶ�����1.2mol���ʴ�Ϊ��O2+4e-+4H+=2H2O��1.2��
| [CH3OH] |
| [CO][H2]2 |
a�����¡����������£����ڷ�Ӧǰ����������仯�ķ�Ӧ���������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ�⣬��a��ȷ��b��һ�������£�H2������������CO���������ʵ�2��ʱ������Եó���Ӧֻ������������У������������淴Ӧ������ȣ���b����
c����������������䣬�����¶ȣ�ƽ������������У��ɽ���CO��ת���ʣ���c����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲻�����CH3OH�IJ����ͷ�Ӧ���ת���ʣ���d����
�ʴ�Ϊ��
| [CH3OH] |
| [CO][H2]2 |
��2�������¶ȣ�ƽ������������У��ɽ���CO��ת���ʣ������¶����ߣ���ѧ��Ӧ���ʼӿ죬�ﵽ��ѧƽ��״̬����ʱ��̣���
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����3�����ݸ�˹���ɣ���ӦCH3OH��l��+O2��g��=CO��g��+2H2O��l���뷴Ӧ��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-a kJ?mol-1��2CO��g��+O2��g��=2CO2��g����H=-b kJ?mol-1��H2O��g��=H2O��l����H=-c kJ?mol-1
��
| 1 |
| 2 |
| b-a-4c |
| 2 |
�ʴ�Ϊ��
| b-a-4c |
| 2 |
��4������װ�ÿ���֪��d�����ɴ�����ˮ������e�缫��ͨ��������������缫��ӦΪ��O2+4e-+4H+=2H2O����6.4g�״���ȫ��Ӧ����CO2ʱ�����ݷ�Ӧ2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g���������ļ״�2molʱ��ת�Ƶ���Ϊ12mol�����Ե�6.4g�״���0.2mol�״���ȫ��Ӧ����CO2ʱ��ת�Ƶ�����1.2mol���ʴ�Ϊ��O2+4e-+4H+=2H2O��1.2��
������������һ���й��Ȼ�ѧ���绯ѧ�Լ���ѧƽ��֪ʶ���ۺ��⣬Ҫ��ѧ�����з����ͽ��������������ѶȽϴ�

��ϰ��ϵ�д�
�����Ŀ

 ��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ���� ��2012?������һģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��2012?������һģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����