题目内容
【题目】下表是元素周期表的一部分,每个编号代表一种元素,请根据要求回答问题:

(1)表中金属性最强的元素为___(填元素符号);
(2)最稳定的元素为___(填元素符号);
(3)③、⑦的原子半径大小关系:③___(填“>”“<”或“=”)⑦);
(4)④和⑦两种元素组成的化合物与AgNO3溶液反应的离子方程式为___。
【答案】Na Ne > C1-+Ag+=AgCl↓
【解析】
根据周期表中的位置各元素为①C②O③Na④Mg⑤Al⑥Ne⑦Cl。
(1)周期表中同主族从上到下,同周期从右到左,金属性增强,表中金属性最强的元素为Na(填元素符号);故答案为:Na;
(2)稀有气体最外层已经达到稳定结构,最稳定的元素为Ne(填元素符号);故答案为:Ne;
(3)同周期从左到右原子半径逐渐减小,③、⑦的原子半径大小关系:③>(填“>”“<”或“=”)⑦);故答案为:>;
(4)④和⑦两种元素组成的化合物MgCl2与AgNO3溶液反应生成氯化银和硝酸镁,离子方程式为C1-+Ag+=AgCl↓。故答案为:C1-+Ag+=AgCl↓。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】向10.00 mL 0.50 mol/L NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
实验 | 序号 | c(CaCl2)(mol·L-1) | 滴加CaCl2溶液时的 实验现象 | 加热浑浊液时的 实验现象 |
| ① | 0.05 | 至1.32 mL时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
② | 0.005 | 至15.60 mL时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
③ | 0.0005 | 至20 mL未见浑浊 |
A.①中产生浑浊的原因是c(Ca2+)·c(CO32)>Ksp(CaCO3)
B.未加热前①和②中发生了反应:2HCO3-+Ca2+=CaCO3↓+H2CO3
C.加热浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2
D.向上述NaHCO3溶液中加入足量0.5 mol/LCaCl2溶液,可能同时产生浑浊和气泡
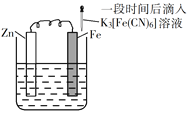
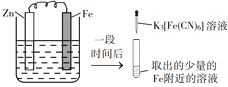
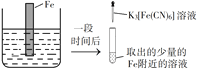
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
【题目】(I)某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)_____。
A.C7H12O2 B.C6H14 C.C6H14O D.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为______________。
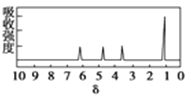
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为____。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_____________.
(II)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:_____。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | A的分子式为:________。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况) | 写出A中含有的官能团____________、________。 |
(4)A的核磁共振氢谱如下图: | 综上所述,A的结构简式为________ |