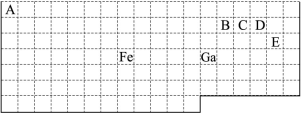
题目内容
短周期元素W、X、Y、Z在元素周期表中的位置关系如图所示。下列说法正确的是

A.A.元素Y的最高价氧化物对应水化物的酸性比Z的强
B.元素Z一定位于元素周期表的第3周期第ⅦA族
C.原子半径的大小顺序为rY>rW>rX
D.元素X可能为硼或碳或氮

A.A.元素Y的最高价氧化物对应水化物的酸性比Z的强
B.元素Z一定位于元素周期表的第3周期第ⅦA族
C.原子半径的大小顺序为rY>rW>rX
D.元素X可能为硼或碳或氮
D
试题分析:A.Y、Z是同一周期的元素。元素的原子序数越大,元素的非金属性就越强,其最高价氧化物对应水化物的酸性就越强。因此元素Z的最高价氧化物对应水化物的酸性比Y的强。错误。B.具有如图所示关系的元素情况比较多,可以是B、Al、Si、P;C、Si、P、S;也可以是N、P、S、Cl.因此该说法不准确。错误。C.同一周期的元素,原子序数越大,原子半径就越小。故原子半径的大小顺序为rW > rY >rX。错误。D.根据选项B的分析可知元素X可能为硼或碳或氮。正确。

练习册系列答案
相关题目